Примеры решенных задач по химии - 6
7. В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86 % аргона и 14 % азота. Рассчитайте парциальное давление каждого из газов, если общее давление равно 39 990 Па.
Решение
Парциальное давление компонентов смеси рассчитываем по формуле:
P(Ar)=P*N(Ar), P(N2)=P*N(N2), где N(N2) и N(Ar) – мольные доли компонентов в смеси.
Находим мольные доли: N(N2)=n(N2)/(n(N2)+n(Ar))
N(Ar)=n(Ar)/(n(Ar)+n(Ar))
Количества вещества газов в смеси находим через молярный объем:
n(Ar)=V(Ar)/Vm; n(N2)=V(N2)/Vm
подставим эти выражения в выражения мольных долей газов:
![]() , следовательно, мольные доли газов в смеси равняются объемным долям:
, следовательно, мольные доли газов в смеси равняются объемным долям:
N(Ar)=φ(Ar)=0,86; N(N2)= φ(N2)=0,14
Находим парциальные давления компонентов:
P(Ar)=P*N(Ar)=39990*0,86=34391,4(Па)
P(N2)=P*N(N2)=39990*0,14=5598,6(Па)
- При пропускании сероводорода через раствор, содержащий 2,98 · 10-3 кг хлорида некоторого одновалентного металла, образуется 2,2 · 10-3 кг его сульфида. Вычислите молярную массу эквивалента металла.
Решение
Неизвестный металл примем за Ме, тогда уравнение реакции имеет вид:
Молярную массу эквивалента металла принимаем за х г/моль, тогда за уравнением реакции составляем уравнение с одним неизвестным, а массы веществ переводим в граммы:
2,98 2,2
2MeCl + H2S => Me2S + 2HCl
2 моль 1 моль
2*(х+35,5) 2х+32
4,4(х+35,5)=2,98(2х+32)
4,4х – 5,96х=95,36-156,2
1,56х=60,84
Х=39 молярная масса эквивалента металла составляет 39 г/моль – металл К – калий.
57.Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n = 4; l = 0; ml = 0; ms = ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей он содержит.
Решение
Главное квантовое число n=4, следовательно, элемент имеет четыре энергетических уровня.
Орбитальное квантовое число l = 0, следовательно, электроны данного элемента находятся на s-орбитали.
Магнитное квантовое число ml = 0, электронная орбиталь одна – s-орбиталь.
Спиновое число имеет только одно значение ms = ±1/2, следовательно, атом элемента имеет только один электрон.
Электронная формула внешнего энергетического уровня имеет вид: 4s1 – данный элемент Калий. Электронная формула калия:
1s22s22p63s23p63d04s1
У атома калия пять свободных 3d- орбиталей.
- Вычислите относительную электроотрицательность углерода, если первый ионизационный потенциал углерода равен 11,26 В, а его сродство к электрону 1,12 эВ.
Решение
Относительная электроотрицательность рассчитаем, как сумму энергии ионизации и сродства к электрону: ЭО=(I+E).
Находим энергию ионизации атома углерода, пересчитываем электронвольт в кДж/моль:
I=11,26*1,602*10-19*6,02*1023=1085,9(кДж/моль)
Находим сродство к электрону:
E=1,12*1,602*10-19*6,02*1023=108 (кДж/моль)
Электроотрицательность углерода будет:
ЭО=(I+E)=1085,9+108=1193,9(кДж/моль)
За единицу электроотрицательности принята электроотрицательность лития
ЭО(Li)=536 (кДж/моль)
Относительная электроотрицательность углерода будет:
ЭО(С)=ЭО/ ЭО(Li)=1193,9/536=2,22
- Определите тип гибридизации и геометрическую форму частицы [SbF6]-.
Решение
При образовании комплексного иона [SbF6] – атом Sb в соответствии с МВС должен находиться в возбужденном состоянии:
Sb [KLMN5s25p3d0] => Sb * [KLMN5s15p3d1],
в котором может образовать по обменному механизму пять связей. Шестая связь должна образоваться по донорно-акцепторному механизму, в соответствии с которым на свободную орбиталь атома Sb поступает электронная пара от атома F. Образование шести равноценных связей возможно при sp3d2 - гибридизации атомных орбиталей сурьмы, что определяет пространственную геометрическую форму иона – октаэдр с валентным углом F-Sb-F, равным 90°.
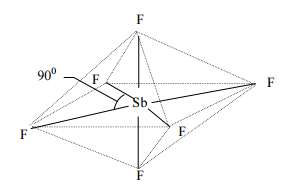
Все связи полярны, но их векторная сумма вследствие симметрии частицы равна нулю - комплексный ион [SbF6] – не имеет дипольного момента.
132.Вычислите молярные массы эквивалентов комплексных солей [Co(NH3)6]I3, [Co(NH3)5I]I2, [Co(NH3)4I2] в реакции с AgNO3.
Решение
[Co(NH3)6]I3 + 3AgNO3 =>3AgI↓ + [Co(NH3)6](NO3)3
1 моль 3 моль
Молярная масса эквивалента комплексной соли будет:
Mэ([Co(NH3)6]I3)=1/3*M([Co(NH3)6]I3)=180,66(г/моль)
[Co(NH3)5I]I2 + 2AgNO3 =>2AgI↓ + [Co(NH3)5I](NO3)2
1 моль 2 моль
Молярная масса эквивалента комплексной соли будет:
Mэ([Co(NH3)5I]I2)=1/2*M([Co(NH3)5I]I2)=271(г/моль)
[Co(NH3)4I2] – электронейтральный комплекс с нитратом серебра в обменные реакции не вступает
- Определите изменение внутренней энергии при испарении 50 г толуола при 30 °С, если на испарение 1 г толуола расходуется 348 Дж тепла. Пары толуола считать идеальным газом, а объемом жидкого толуола пренебречь.
Решение
Количество теплоты потраченное на испарение 50 г толуола будет:
Q=m*q=50*348=17400 (Дж)
Согласно уравнению состояния идеального газа работа, затрачена на расширение газа будет:
A=nRT=50*8,314*303/92=1369,1(Дж)
Согласно первому закону термодинамики изменение внутренней энергии будет:
∆U=Q-A=17400-1369,1=16030,9(Дж)
- Изменение энтропии при плавлении 100 г меди равно 1,28 Дж/К. Рассчитайте удельную теплоту плавления меди, если температура плавления меди равна 1083 °С.
Решение
Изменение энтропии согласно второму началу термодинамики будет:
∆S=Q/T, отсюда количество теплоты при плавлении меди будет:
Q=∆S*T=1,28*1356=17356,8(Дж)
Удельная теплота плавления меди будет:
λ=Q/m=17356,8/0,1=173568(Дж/кг)=173,568(кДж/кг)
- Вычислите изменение энергии Гиббса и определите возможность протекания этой реакции при стандартных условиях СО(г) + Н2О(ж) = СО2(г) + Н2(г).
Решение
СО(г) + Н2О(ж) = СО2(г) + Н2(г)
|
Вещество |
∆Н, кДж/моль |
S, Дж/моль*К |
|
CO2 |
-393,51 |
213,67 |
|
Н2 |
0 |
130,5 |
|
H2O |
-285,83 |
70,08 |
|
СО |
-110,5 |
197,4 |
По второму следствию из закона Гесса:
ΔHf298 =ΔHf(СО2(г))+ΔHf(Н2(г)) – ∆H(СО(г))-ΔHf(Н2О(ж))=
=(-393,51) +(0) – (-110,5)-(-285,83) = 2,82 (кДж/моль)=2820(Дж/моль)
изменение энтропии при температуре 298К :
ΔSf298 =ΔSf(СО2(г))+ΔSf(Н2(г)) – ∆S(СО(г))-ΔSf(Н2О(ж))=
=(213,67) + (130,5) – (70,08)-(197,4) = 76,69 (Дж/К*моль)
Изменение энергии Гиббса при Т=298К по уравнению Гиббса-Гельмгольца:
∆G0298=∆H0298-T∆S0298= 2820 - 298*(76,69)= -20033,62(Дж/моль) ∆G0298<0 реакция идет в прямом направлении
- Температурный коэффициент скорости реакции разложения йодоводорода по реакции 2HI = H2 + I2 равен 2. Вычислите константу скорости этой реакции при 684 К, если при 629 К константа скорости равна 8,9 · 10-5 л / (моль · с).
Решение
k1=8,9 · 10-5 л / (моль · с); Т1=629 К; γ=2;
По уравнению Вант – Гоффа определяем константу скорости реакции при Т2=684 К
![]() отсюда
отсюда ![]()
- В системе 2NO2 ↔ N2O4 при 60 °С и стандартном давлении установилось равновесие. Во сколько раз следует уменьшить объем, чтобы давление возросло в 2 раза?
Решение
При температуре 60 0С по реакции
2NO2 ↔ N2O4 установилось равновесие между двумя фазами газообразной NO2 и жидкой N2O4. Давление и объем связаны соотношением P0/V0=P1/V1, следовательно, для увеличения давления в 2 раза необходимо, соответственно, уменьшить объем в 2 раза.
282. Водный раствор аммиака массой 2,12 г разбавлен в мерной колбе вместимостью 250 мл. На титрование 10 мл разбавленного раствора затрачено 8,4 мл титранта с концентрацией с(HCl) = 0,107 моль/л. Рассчитайте массовую долю аммиака в исходном растворе.
Решение
Уравнение титрования:
NH3 + HCl => NH4Cl
По результатам титрования находим молярную концентрацию аммиака в растворе:
C(NH3)*V1=C(HCl)*V(HCl)
C(NH3)= C(HCl)*V(HCl)/V=8,4*0,107/10=0,08988(моль/л)
Находим количество вещества аммиака в растворе обемом 250 мл:
n(NH3)= C(NH3)*V2=0,08988*0,25=0,02247(моль)
масса аммиака в растворе будет:
m(NH3)= n(NH3)*M(NH3)=0,02247*17=0,38199(г)
Массовая доля аммиака в исходном растворе будет:
ω(NH3)=m(NH3)*100%/m(раствора)=0,38199*100%/2,12=18,018%
