Примеры решенных задач по химии - 5
Тема 1.
(NH4)3PO4 – фосфат аммония
(NH4)2HPO4 – гидрофосфат аммония
NH4H2PO4 – дигидрофосфат аммония
Тема 2.
Уравнение Клапейрона-Менделеева:
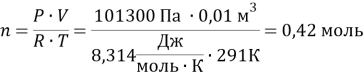
![]()
Тема 3.
Для металлов характерны оксиды Ме2О, МеО, Ме2О3. Рассмотрим каждый из этих вариантов.
1) Ме2О + Н2 = 2Ме + Н2О
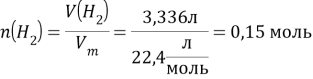
По уравнению реакции определяем, что ![]()
![]()
![]()
Металла с таким значением относительной атомной массы нет.
2) МеО + Н2 = Ме + Н2О
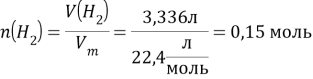
![]()
![]()
![]()
Неизвестный металл – медь.
![]()
3) Ме2О3 + 3Н2 = 2Ме + 3 Н2О
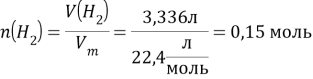
![]()
![]()
![]()
Такого металла нет.
Тема 4.
а) 48
б) 31
Тема 5.
Формула летучего водородного соединения Н2Э
2:1 = n(H):n(Э)
Пусть масса Н2Э равна 100 г, тогда ![]()
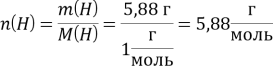
![]()
2:1 = 5,88:![]()
М(Э) = 32 г/моль, элемент – сера.
Мэ(S) = 16 г/моль
Тема 6.
CS2 + 3O2 = CO2 + 2SO2
![]()
![]()
Справочные данные:
![]()
![]()
![]()
![]()
![]()
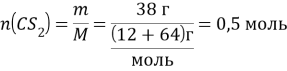
![]()
Тема 7.
Уравнение Вант – Гоффа: 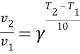
15,6 = γ3
γ=2,5
Тема 8.
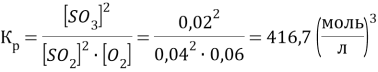
На образование 0,02 моль/л ![]() по уравнению реакции необходимо 0,02 моль/л
по уравнению реакции необходимо 0,02 моль/л ![]() и 0,01 моль/л
и 0,01 моль/л ![]() .
.
Сисх(![]() ) =0,04 +0,02 = 0,06 моль/л
) =0,04 +0,02 = 0,06 моль/л
Сисх(![]() )=0,06 + 0,01 = 0,07 моль/л
)=0,06 + 0,01 = 0,07 моль/л
Тема 9
[Co(CN)4]2- → Co2+ + 4CN-
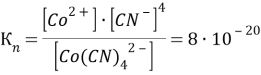
[Hg(CN)4]2- → Hg2+ + 4CN-
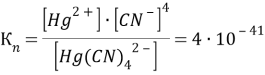
[Cd(CN)4]2- → Cd2+ + 4CN-
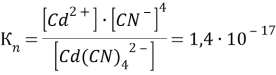
Чем больше численное значение константы нестойкости, тем в большей степени происходит диссоциация и тем больше ионов образуется в растворе. Таким образом, наибольшее количество ионов в растворе [Cd(CN)4]2.
Тема 10.
а) NaHCO3 + HCl = NaCl + H2CO3
Na+ + HCO3- + H+ + Cl- = Na+ + Cl- + H2CO3
HCO3- + H+ = H2CO3
б) Pb(CH3COO)2 + Na2S = PbS + 2CH3COONa
Pb2+ + 2CH3COO- + 2Na+ + S2- = PBS + 2CH3COO- + 2Na+
Pb2+ + S2- = PbS
в) 2KHS + H2SO4 = K2SO4 + 2H2S
2K+ + 2HS- + 2H+ + SO42- = 2K+ + SO42- + 2H2S
HS- + H+ = H2S
