Примеры решенных задач по химии - 4
Часть 1
№ 10
MeCl2 + 2AgNO3 = Me(NO3)2 + 2AgCl
Определяем химическое количество хлорида серебра:
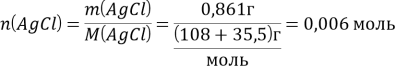
Из уравнения реакции следует, что ![]()
Определяем молярную массу хлорида металла:
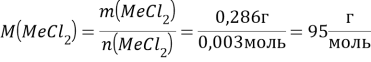
![]()
Следовательно, неизвестный металл – магний.
![]()
Эквивалентная масса хлора равна 35,5 г/моль, а молярная масса хлора как простого вещества равна 71 г/моль, поэтому эквивалентный объем в 2 раза меньше молярного, т е равен 11,2 л.
№105
Решение:
На основании уравнения Аррениуса: 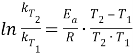
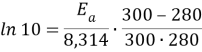
Ea=80,313 кДж/моль
К - константа скорости реакции, показывающая, с какой скоростью протекает реакция при концентрациях веществ, равных 1 моль/л. Численное значение константы скорости зависит от природы реагирующих веществ, температуры присутствия катализатора.
Энергия активации – минимальная энергия, которую необходимо сообщить частицам, чтобы их взаимодействие было эффективным. Численное значение энергии активации зависит от природы реагирующих веществ и присутствия катализатора.
№131
Решение:
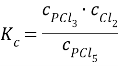
К моменту равновесия концентрации веществ на основании уравнения реакции: с(PCl5) = 0,5 ∙ 1 = 0,5 моль/л
с(PCl3) = с(Cl2) = 0,5 моль/л

Т.к. в закрытом сосуде при постоянной температуре ![]() , то
, то
Р равн = (0,5 + 0,5 + 0,5) ∙ 8,314 ∙298 = 3716 Па.
№181
Решение:
а) ![]() - сильный электролит, поэтому диссоциирует полностью.
- сильный электролит, поэтому диссоциирует полностью.
![]()
Из уравнения диссоциации следует, что ![]()
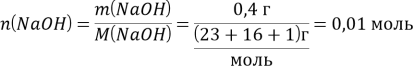
![]()
![]()
б) NH4OH – слабый электролит, поэтому диссоциирует не полностью
NH4OH ⟷ NH4+ + OH-
![]()
![]()
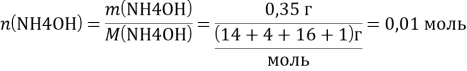
![]()
![]()
№220
Решение:
![]()
![]()
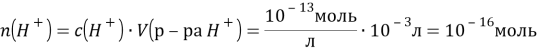
![]()
Часть 2.
№13
Решение:
Справочные данные:
![]()
![]()
![]()
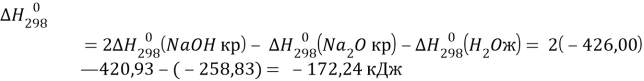
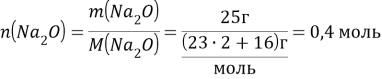
1 моль ![]() - -172,24 кДж
- -172,24 кДж
0,4 моль ![]() - х кДж
- х кДж
![]()
№27
Решение:
![]()
![]()
Справочные данные:
![]()
![]()
![]()
![]()
№55
Решение:
Вероятность протекания реакции в обоих направлениях одинакова в состоянии равновесия.
В состоянии равновесия ![]()
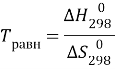
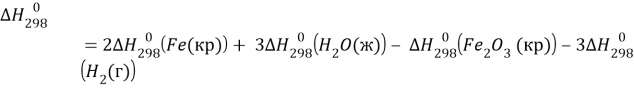
![]()
Справочные данные:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
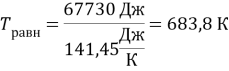
№86
Решение:
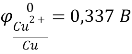
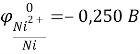
Т к ![]() , то медь является катодом, а никель – анодом.
, то медь является катодом, а никель – анодом.
Cu| электролит рН=2|Ni
A: Ni – 2e → Ni2+ ![]()
K: 2H+ + 2e → H2 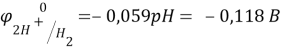
Ni + 2H+ = Ni2+ + H2
![]()
![]()
Если электроды заменить на электроды 1 рода, то получим элемент Якоби-Даниеля.
Ni|Ni2+ ||Cu2+ |Cu
A: Ni – 2e → Ni2+ ![]()
K: Cu2+ +2e →Cu ![]()
![]()
Т е при замене электродов ![]() увеличивается.
увеличивается.
№108
Решение:
K: Ag+ + 1e → Ag
A: 2H2O – 4e → O2 + 4H+
4Ag+ + 2H2O→ 4Ag + O2 + 4H+
4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3
![]()
![]()
![]()
На аноде выделится кислород.
![]()
Из уравнения реакции следует, что ![]()
![]()
№135
Решение:
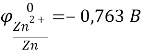
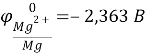
На основании справочных данных определяем, что магний является анодом, а цинк – катодом.
A: Mg – 2e → Mg2+
K: O2 + 2H2O + 4e → 4OH-
На основании второго закона Фарадея: ![]()
![]()
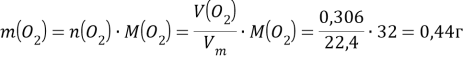
![]()
Т е масса анода уменьшилась на 0,32 г.
![]()
№155
Решение:
К(-) Сu (чист.) |CuSO4| Cu (с примесями) (+)А
Справочные данные:
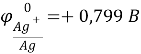
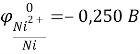
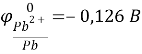
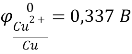
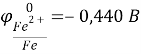
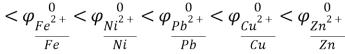
Отсюда следует, что железо, никель и свинец растворяются на аноде и не осаждаются на катоде, а серебро не будет окисляться и в виде порошка осядет на дно сосуда.
А: Pb – 2e → Pb2+
Fe – 2e → Fe2+
Ni – 2e → Ni2+
K: Сu2+ + 2e → Cu
Имя файла: him6.docx
Размер файла: 27.81 Kb
Если закачивание файла не начнется через 10 сек, кликните по этой ссылке
