Примеры решенных задач по химии - 10
1. Осмос и осмотическое давление. Закон Вант-Гоффа. Плазмолиз, плазмолиз и тургор в живых клетках. Растворы изотонические, гипертонические, гипотонические.
Ответ:
Осмосом называют преимущественно одностороннее проникновение молекул растворителя(диффузию) через полунепроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Закон Вант-Гоффа:
Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффиценту пропорциональности и абсолютной температуре: π =С(Х)RT,
Где π- осмотич давление,кПа; С(Х)- молярная концентрация, моль/л
С(Х)= n/V, где n-число молей неэлектролита, V- объём раствора; R- универсальная газовая постоянная,равная 8,31кПа*л/(моль*К); T-абсолютная температура, K.
π = n/V * RT или πV= nRT.
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Осмотическое давление зависит от концентрации растворенного вещества и температуры. Так, при увеличении концентрации с сахарозы в воде в два раза осмотическое давление возрастает примерно в два раза, при увеличении концентрации c в три раза осмотическое давление возрастает почти во столько же и т. д.
Слой протоплазмы живой клетки, граничащий с оболочкой, обладает свойством полупроницаемости. Он пропускает воду, но задерживает большую часть растворенных в воде веществ, препятствуя выравниванию концентраций в клетке и в межклеточном пространстве. В связи с этим растворенные в клеточном соке вещества оказывают на цитоплазму осмотическое давление, величина которого определяется по уравнению
р = CRT,
где р — давление, Па;
С — молярная концентрация раствора, моль/м3;
R—газовая постоянная, равная 8,3 Дж/(моль·К);
Т—абсолютная температура, К.
Осмотическое давление в клетках зрелых плодов и овощей обычно колеблется от 0,49 до 0,98 МПа. Благодаря этому протоплазма плотно прижата к оболочке клетки, которая растягивается во все стороны. Это напряженное состояние клетки носит название тургора (рис. 1, а).
Тургор можно нарушить, насытив межклеточное пространство концентрированными растворами сахара или поваренной соли. При молярной концентрации, более высокой, чем концентрация клеточного сока, окружающий клетку раствор обладает и большим осмотическим потенциалом. Часть влаги переходит из клетки в межклеточное пространство, и протоплазма сжимается. Такое явление носит название плазмолиза (рис. 1, б).
Если устранить действие концентрированных растворов, например, вытеснив их водой, то тургор может восстановиться. Такое явление называется де клазмолизом. Степень обратимости зависит от вида, концентрации и длительности действия растворенного вещества.
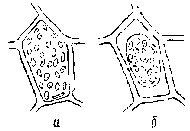
Рис. 1. Тургор (а) и плазмолиз (б) растительной клетки
Необратимые изменения протоплазмы вызываются нагреванием, под действием которого свертываются белки. Для коагуляции цитоплазмы клеток плодовой ткани достаточно 50—60°С. Цитоплазма семян, содержащая пониженное количество влаги, выдерживает нагревание до 70—80°С.
Изотонический раствор- жидкость внутренней среды или искусственно приготовленный раствор имеет такое же осмотическое давление, как нормальная плазма крови, подобную жидкую среду или раствор
Гипертонический раствор жидкость с более высоким осмотическим давлением
Гипотонический раствор жидкость с более низким осмотическим давлением
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Изотонический коэффициент или коэффициент Вант-Гоффа (i) – это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита, по его величине вычисляют степень электролитической диссоциации:
Формулы для расчета коллигативных свойств разбавленных растворов электрполитов с учетом изотонического коэффициента имеют вид:
- осмотическое давление Росм = ί См RT;
- 1-й закон Рауля ΔР / Р(z) = ί Сm ;
- 2-й закон Рауля tкp = ί Ккр Cm; Δtкип = ίКкип Cm.
2. Методы получения коллоидных растворов: диспергирование, конденсация, пептизация. Применение этих методов для получения пищевых продуктов.
Ответ:
Как известно, золи по размеру частиц дисперсной фазы занимают промежуточное положение между истинными растворами и суспензиями, поэтому, естественно, они могут быть получены либо путем соединения отдельных молекул или ионов растворенного вещества в агрегаты, либо в результате диспергирования сравнительно больших частиц. В соответствии с этим Сведберг делит методы синтеза коллоидных систем на конденсационные и диспергационные. Особо от этих методов стоит метод пептизации, который заключается в переводе в коллоидный раствор осадков, первичные частицы которых уже имеют коллоидные размеры. Наконец, в некоторых случаях коллоидные системы могут образовываться путем самопроизвольного диспергирования дисперсной фазы в дисперсионной среде.
Основными двумя условиями получения коллоидных систем, независимо от применяемых методов синтеза, являются: нерастворимость дисперсной фазы в дисперсионной среде и наличие в системе, в которой образуются частицы, веществ, способных стабилизировать эти частицы. Такими веществами могут быть как чужеродные вещества, специально вводимые в систему, так и соединения, образующиеся при взаимодействии дисперсной фазы с дисперсионной средой.
Диспергационные методы получения дисперсных систем
Диспергированием называют такое измельчение твердых и жидких тел в инертной (не взаимодействующей с измельчаемым веществом) среде, при котором резко повышается дисперсность и образуется дисперсная система, обладающая значительной удельной межфазной поверхностью. В противоположность растворению диспергирование происходит, как правило, не самопроизвольно, а с затратой внешней работы, расходуемой на преодоление межмолекулярных сил при дроблении вещества.
Процесс диспергирования имеет большое практическое значение в ряде производств и технологических процессов: при получении высокодисперсных порошков, пигментов для красок, при измельчении руд полезных ископаемых, при изготовлении муки и других пищевых продуктов и т.д.
Известны различные способы диспергирования.
Для получения грубодисперсных систем служат шаровые мельницы, представляющие собой полые, вращающиеся цилиндры, содержащие некоторое количество стальных или керамических шаров. При вращении цилиндра эти шары перекатываются, дробя и истирая измельчаемый материал. В шаровых мельницах получают порошки, цемент, густотертые краски и т.п.; размер частиц дисперсной фазы в них можно довести лишь до 1000 нм. Для более тонкого измельчения – до *** нм и меньше – используют коллоидные мельницы, в которых измельчаемый материал (грубая суспензия), проходя через зазор между вращающимся ротором и корпусом мельницы, подвергается дальнейшему измельчению. В коллоидных мельницах получают акварельные краски, пудру, лекарственные препараты и т.п.
Конденсационные методы получения дисперсных систем
Методы конденсации по сравнению с методами диспергирования дают возможность получать коллоидные системы более высокой дисперсности.
Конденсационные методы получения дисперсных систем основаны на создании условий, при которых будущая дисперсионная среда пересыщается веществом будущей дисперсной фазы. В зависимости от способов создания этих условий конденсационный метод подразделяют на физический и химический.
К физическим методам относятся:
а) Конденсация паров при пропускании их через холодную жидкость, в результате чего образуются лиозоли. Так, при пропускании паров кипящей ртути, серы, селена в холодную воду образуются их коллоидные растворы.
б) Замена растворителя. Метод основан на том, что вещество, из которого хотят получить золь, растворяют в подходящем растворителе, затем добавляют вторую жидкость, являющуюся плохим растворителем для вещества, но хорошо смешивающуюся с исходным растворителем. Растворенное первоначально вещество выделяется из раствора в высокодисперсном состоянии. Например, таким путем можно получить гидрозоли серы, фосфора, канифоли, парафина, вливая их спиртовый раствор в воду.
Химическая конденсация отличается от всех рассмотренных выше методов тем, что диспергируемое вещество берут не в готовом виде, а получают непосредственно в растворе химической реакцией, в результате которой образуется нерастворимое в данной среде нужное соединение. Задача сводится к тому, чтобы получить выпадающий осадок в мелкодисперсном состоянии. В методах химической конденсации используются любые реакции, ведущие к образованию новой фазы: реакции двойного обмена, разложения, окисления-восстановления и т.д. Стабилизатором коллоидного раствора служит обычно один из участников реакции или побочный продукт, из которых на границе раздела частица – среда образуются адсорбционные слои ионного или молекулярного типа, препятствующие слипанию частиц и выпадению их в осадок.
3. Общая характеристика четвертой аналитической группы катионов. Значение катионов четвертой аналитической группы в проведении химико-технологического контроля.
Ответ:
Аналитические реакции катионов IV аналитической группы по кислотно-основной классификации: Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+
Групповой реагент - гидроксид натрия или калия в присутствии Н2О2
Аналитические реакции катиона цинка Zn2+
1. Реакция с щелочами:
Zn2+ + 2 ОН- = Zn(OH)2 (белый)
Zn(OH)2 + 2 ОН- = [Zn(OH)4]2- (бесцветный)
2. Реакция с раствором аммиака:
Zn2+ + 2 NH3∙H2O → Zn(OH)2 (белый) + 2 NH4+
Zn(OH)2 + 4 NH3 → [Zn(NH3)4](OH)2 (бесцветный)
Осадок нерастворим в разбавленной НС1, растворяется в щелочах.
3. Реакции с сульфид-ионами (фармакопейная):
Zn2+ + S2- = ZnS (белый)
Реакцию часто проводят в уксусной среде.
4. Реакция с гексацианоферратом (II) калия
Реакцию проводят в нейтральной или слабокислой среде, при нагревании
2 К+ + 3 Zn2+ + [Fe(CN)6]4- = К2Zn3[Fe(CN)6]2 (белый)
Осадок нерастворим в разбавленной НСl, растворяется в щелочах
5.Реакция с литизоном (дифенилтиокарбазоном). В растворах дитизона
устанавливается таутомерное равновесие между тионной и тиольной формами:
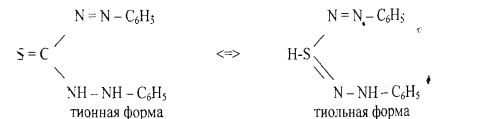
В результате реакции с катионами цинка возникает внутрикомплексное соединение, содержащее два дитизонатных аниона:
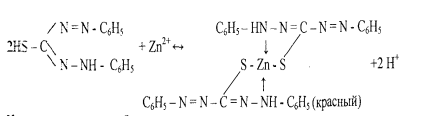
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекуле воды. 6. Реакция образования -зелени Ринмана-.
Zn(NO3)2+ Co(NО3)2 → CoZnО2 (зеленый) + 4 NO2 + О2.
-Зелень Ринмана- - смешанный оксид кобальта и цинка CoZnO2 зеленого цвета.
Другие реакции катионов цинка.
Катионы Zn2+ при взаимодействии с различными другими реактивами образуют осадки: с Na2HPO4 - белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке); с К2СrО4 -желтый ZnCrO4 (растворяется в кислотах и щелочах); с СоС12 и (NH4)2[Hg(SCN)4] -голубой ZnCo[Hg(SCN)4]; а также с различными орг. реагентами.
Аналитические реакции катиона алюминия Al3+
1.Реакция с щелочами:
А13+ + 3 ОН- → А1(ОН)3(белый)
А1(ОН)3 + 3 ОН- → [А1(ОН)6]3-
После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4C1). Смесь нагревают. Гидроксокомплексы разрушаются выпадает осадок А1(ОН)3:
[А1(ОН)6]3- + 3 NH4+ → А1(ОН)3 + 3 NH3 + 3 Н2О
Наиболее полное осаждение гидроксида алюминия происходит при рН- 5-6. Осадок А1(ОН)3 растворяется в кислотах, но не растворяется в аммиаке.
2.Реакция с аммиаком.
А13+ + 3 NH4∙Н2O → А1(ОН)3↓ (белый аморфный) + 3 NH4+
3.Реакция с нитратом кобальта - образование -тенаровой сини-.
-Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.
2 A12(SO4)3 + 2 Co(NO3)2 → 2 Со(А1О2)2 + 4 NO2 + 6 SO3 + O2.
4. Реакция с алюминоном
Катионы А13+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для кратности NH4L) образуют в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состав A1(ОН)2L. Точное строение комплекса неизвестно. Выпадает красный хлопьевидный осадок. Мешают катионы Са2+, Cr3+, Fe3+
5. Реакция с ализарином (1,2 - диоксиантрахинон).
Катионы А13+ с ализарином и его производными в аммиачной среде образует комплексы ярко красного цвета называемые -алюминиевыми лаками-.
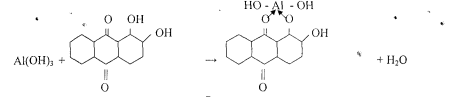
Комплекс устойчив в уксусной среде. Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают катионы: Zn2+, Sn(II), Cr3+, Mn2+, Fe3+ и др.
Другие реакции катиона алюминия А13+.
Катионы А13+ образуют также осадки при реакциях в растворах: с Na2HPO4 - белый А13РО4, с CH3COONa- белый СН3СООА1(ОН)2, с оксихинолином (кратко Нох) - желто-зеленый [А1(О)3] и др.
Аналитические реакции катиона олова (II)
1.Реакция с щелочами: Sn2+ + 2 ОН- - Sn(OH)2↓ (белый)
Sn(OH)2 + 2 ОН- = [Sn(OH)4]2-
2.Реакциясаммиаком: Sn2+ + 2 NH3∙H2O → Sn(OH)2(белый) + 2 NH4CI
Осадок не растворяется в избытке аммиака.
3.Реакция с сульфид - ионами: Sn2+ + S2- → SnS↓ (бурый)
Осадок не растворяется в щелочах, в избытке раствора сульфида натрия..
4.Реакция с солями висмута (III).Олово (II) является хорошим восстановителем:
2 Bi3+ + 3 [Sn(OH)4]2- + 6 ОН- → 2 ** + 3 [Sn(OH)6]2-
5.Реакция с хлоридом ртути(II): [SnCl4]2- + 2 HgCI2 → Hg2Cl2↓ + [SnCl6]2-
Выпадает белый осадок каломели Hg2Cl2, который постепенно чернеет за счетвыделяющейся металлической ртути: [SnCl4]- + Hg2Cl2 → 2 Hg + [SnCl6]2-
Другие реакции олова (II).
Соединения олова (II) при взаимодействии с молибдатом аммония образуют такназываемую -молибденовую синь- (раствор окрашивается в синий цвет); с Na2HPO4дают белый осадок Sr3(PO4)2 (растворяется в кислотах и щелочах);при реакции с FeCI3 восстанавливают железо (III) до железа (II), причем в присутствиигексацианоферрата (III) калия K3[Fe(CN)6] раствор сразу же окрашивается в синийцвет вследствие образования турибуллевой сини.
Аналитические реакции олова (IV)
Олово (IV) обычно открывают, предварительно восстановив его металлическим железом, магнием, алюминием и т.д. до олова (II). Затем проводят реакции, характерные для олова (II), как описано в предыдущем разделе.
1. Реакция олова (IV), с щелочами:
Sn4+ + 4 ОН- = Sn(ОН)4 (белый)
Осадок растворяется в избытке р-ра щелочи с образованием гидрокомплексов.
Sn(ОН)4 + 2 ОН- = [Sn(ОН)6]2-
2. Реакция с сульфид ионами: Н2[SnCl6] + 2Н2S = SnS2 (желтый) + 6 НCl
Выпадает желтый осадок сульфида олова (IV), который в отличие от сульфида олова (II), растворяется в избытке(NH4)2S или Nа2S с образованием тиосолей.
SnS2 + (NH4)2S = (NH4)2SnS3.
3. Реакция восстановления олова (IV) до олова (II):
[SnCl6]2- + Fe → [SnCl4]2- + Fe2+ + 2 Cl-.
Олово (II) полученное после восстановления олова (IV), открывают реакциями с солями висмута (III), с хлоридом ртути (II).
Другие реакции олова (IV).
С рядом органических реагентов олово (IV) образует окрашенные или• малорастворимые комплексы. С хлоридами рубидия и цезия олово (IV) образует малораетворимые комплексные соли состава Rb2[SnCl6] и Cs2[SnCls].
Аналитические реакции мышьяка (III) и мышьяка (V)
Мышьяк (III) и мышьяк (V) обычно открывают в виде арсенит - иона AsO33- и арсенат - ионов AsO3- соответственно, т.е. в форме анионов, а не в форме катионов.
Значение катионов IV аналитической группы заключается в том, что большинство катионов являются ядами при их определенных концентрациях в продуктах питания. А некоторых из них и вовсе не должно быть в продуктах. Поэтому проведение качественных реакций на катионы IV аналитической группы является одной из главных задач химико-технологического контроля.
4. Рассчитайте тепловой эффект химической реакции:
S + 2CO2 = SO2 + 2CO
если в данную реакцию вступило 10 г серы. Стандартные теплоты сгорания равны ΔН(S) = 0 кДж/моль ΔН(SO2) = -296,9 кДж/моль ΔН(CO) = -110,53 кДж/моль ΔН(CO2) = -393,51 кДж/моль.
Решение:
∆Н0х.р. = (ΔН(S) + 2∙ΔН(CO2)) – (ΔН(SO2) + 2∙ΔН(CO)) = (0 + 2∙(-393,51)) – (-296,9 + 2∙(-110,53)) = -269,06 кДж/моль
ν(S) = m(S)/M(S) = 10/32 = 0,3125 моль
Составим пропорцию:
1 моль серы – -269,06 кДж
0,3125 моль серы – х кДж
∆Нр = ∆Н0х.р.∙ν(S) = (-269,06)∙0,3125 = -84,08 кДж
Ответ: ∆Нр = -84,08 кДж.
5. Написать мицеллу золя иодида свинца (II), полученного при сливании раствора нитрата свинца и избытка иодида калия.
Решение:
Уравнение реакции:
Pb(NO3)2 + 2KIизб = PbI2↓ + 2KNO3
Формула мицеллы золя:
{[PbI2]m·nI–·(n-x)K+}x–·xK+
6. Вычислите сколько граммов вещества Ca(OH)2 содержится в 250 мл раствора, если на титрование 20 мл его затрачено 19,85 мл раствора хлороводородной кислоты с нормальной концентрацией 0,5 н.
Решение:
Уравнение реакции:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
MЭ(Ca(OH)2) = M(Ca(OH)2)/2 = 74,1/2 = 37 г/моль
m(Ca(OH)2) = (CЭ(HCl)∙V(HCl)∙MЭ(Ca(OH)2)∙V(р-ра))/(1000∙V(аликвоты)) = (0,5∙19,85∙37,05∙250)/(1000∙20) = 4,5965 г
Ответ: m(Ca(OH)2) = 4,5965 г.
