Пример решенной контрольной работы по неорганической химии
КОНТРОЛЬНАЯ РАБОТА
Вариант 1
1. Написать электронные формулы строения электронных оболочек атомов элементов с зарядами ядер +20 и +35. Определить возможные степени окисления этих атомов в их соединениях.
Порядок заполнения электронами электронных орбиталей в атомах элементов следующий:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 и т.д.
Порядковый номер элемента равен заряду ядра, и, соответственно, равен числу электронов.
Следовательно, в атоме элемента с зарядом ядра +20 содержится 20 электронов.
На первом энергетическом уровне находятся 2 электрона: 1s2
На втором энергетическом уровне находятся 8 электронов, 2 на s-подуровне и 6 – на р-подуровне: 2s2 2р6.
На третьем энергетическом уровне находятся также 8 электронов, 2 на s-подуровне и 6 – на р-подуровне: 3s2 3р6
На четвертом энергетическом уровне находятся оставшиеся 2 электрона на 4s подуровне. Общая электронная формула элемента запишется:
1s2 2s2 2p6 3s2 3p6 4s2
Так как на внешнем энергетическом уровне находятся всего 2 электрона, элемент проявляет ярко-выраженные металлические свойства, в своих соединениях будет проявлять только одну степень окисления, +2.
Аналогично рассматриваем элемент с зарядом ядра +35.
Аналогично рассматриваем элемент с зарядом ядра +35.
В атоме элемента содержится 35 электронов.
На первом энергетическом уровне находятся 2 электрона: 1s2
На втором энергетическом уровне находятся 8 электронов, 2 на s-подуровне и 6 – на р-подуровне: 2s2 2р6
На третьем энергетическом уровне также находятся 8 электронов, 2 на s-подуровне и 6 – на р-подуровне: 3s2 3р6
На четвертом энергетическом уровне находятся оставшиеся 17 электронов. Из них первые 2 - на 4s подуровне, 10 – на предвнешнем 3d подуровне и 5 на 4р-подуровне.
Общая электронная формула элемента запишется:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р5
Так как на внешнем энергетическом уровне находятся 7 электронов (2 на 4s и 5 на 4р подуровнях), элемент проявляет ярко-выраженные неметаллические свойства. в своих соединениях с сильными окислителями может проявлять степени окисления от +1 до +7 (максимальная степень окисления +7); в соединениях с восстановителями (с металлами или водородом) только одну степень окисления: -1.
2. На примере образования иона аммония (NH4)+ из Н+ и NH3 объяснить сущность и механизм образования донорно-акцепторной связи.
Донорно-акцепторная связь - химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).
Рассмотрим молекулу аммиака.
Согласно теории валентных связей атомные орбитали элемента, участвующие в образовании связи, гибридизуются (выравниваются).
Так атом азота имеет в нормальном состоянии следующее строение:
N 1s2 2s2 2p3.
Атом водорода имеет следующее строение:
H 1s1
При образовании химической связи все 4 орбитали гибридизуются, все гибридные орбитали образуют тетраэдр (sp3 гибридизация).
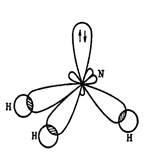 Три гибридные орбитали азота перекрываются с облаками атомов водорода, а на четвертой находится неподеленная пара электронов:
Три гибридные орбитали азота перекрываются с облаками атомов водорода, а на четвертой находится неподеленная пара электронов:
 |
Таким образом, в молекуле аммиака все 3 связи являются ковалентными полярными с пространственным направлением от атомов водорода к атому азота, вдоль воображаемых линий, соединяющих центры ядер атомов.
Образование иона аммония NH4+ происходит за счет донорно-акцепторной связи, то есть атом азота отдает неподеленную электронную пару с 2s-орбитали (является донором) на свободную s-орбиталь иона Н+, который является акцептором:
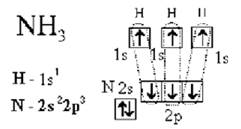
--- ДА связь
![]() H+ 1s0
H+ 1s0
Схематически это можно изобразить:




 Н
Н
..
H : N :H
 ..
..
H
То есть три электронные пары (черным цветом) образуют ковалентные связи, четвертая пара(красным цветом) образует донорно-акцепторную связь.
В катионе аммония атом азота также находится в состоянии sp3 гибридизации, сам ион имеет такое же, как и NH3, тетраэдрическое строение:
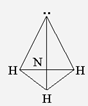 Н
Н
3. Определить, с какими из перечисленных соединений будет взаимодействовать оксид серы (IV): NaOH, H3PO4, H2O, Cr2O3, MnSO4, Be(OH)2, H2SO4 и KCl. Составить уравнения соответствующих реакций и назвать получаемые продукты.
Оксид серы (IV) реагирует со следующими веществами:
а) Гидроксид натрия. В результате образуется сульфит натрия:
SO2 + 2NaOH → Na2SO3 + H2O
б) С водой. В результате образуется слабая сернистая кислота:
SO2 + H2O = H2SO3
в) При высокой температуре возможна реакция с оксидом хрома (III)/ В результате образуется сульфит хрома (III):
SO2 + Cr2O3 = 2CrSO3
С остальными веществами диоксид серы не реагирует.
4. Для получения никеля используют реакцию восстановления оксида никеля (II) углеродом:
NiO + C = Ni + CO. Определить массу угля, которую необходимо взять для получения никеля массой 295 г.
Согласно уравнению реакции, 1 моль никеля образуется при взаимодействии 1 моль оксида никеля (II) и 1 моль углерода (угля).
Находим число моль полученного никеля:
n(Ni) = m/M = 295 / 59 = 5 моль.
Следовательно, необходимое количество угля также равно 5 моль.
Находим необходимую массу угля:
m(C) = n(C)*M = 5*12 = 60 грамм.
5. Рассчитать, как изменится скорость прямой и обратной реакций в гомогенной системе
2SO2 + O2 Û 2SO3, если уменьшить объем в два раза? Сместиться ли при этом равновесие системы?
Скорость реакции по закону действия масс равна:
v = k*Caa*Cbb*Ccc….. где k – константа скорости реакции, C – концентрации веществ в степенях, равных стехиометрическим коэффициентам. В случае гетерогенных реакций, в выражение закона действующих масс включаются только концентрации газообразных продуктов.
Тогда, для данного процесса, скорости прямой и обратной реакций равны:
vпр = k*C2(SO2)*C(O2)
vобр = k`*C2(SO3)
При уменьшении объема в системе увеличиваются концентрации газообразных веществ.
Согласно уравнению Менделеева – Клапейрона PV = CRT, то есть при уменьшении объема в 2 раза, концентрации веществ также увеличатся в 2 раза, тогда:
v`пр = k*(2*C(SO2))2*2C(O2) = 8k*C2(SO2)*C(O2) = 8*vпр
То есть скорость прямой реакции увеличится в 8 раз.
Соответственно:
v`обр = k`*(2*C(SO3))2 = 4*k`*C2(SO3) = 4vобр
То есть скорость обратной реакции увеличится в 4 раза.
Так как изменение скоростей неравнозначно, скорость прямой реакции увеличивается сильнее, то равновесие сместится в сторону протекания прямой реакции.
6. Указать и объяснить, в каком направлении будет смещаться равновесие в следующих
системах:
|
2СО(г) Û СО2(г) + С(к); |
DНo = 119 кДж; |
а) при повышении температуры; б) при понижении общего давления. Написать выражения для константы равновесия этих реакций.
Согласно принципу Ле-Шателье: Если на систему, находящуюся в равновесии оказать воздействие из-вне, равновесие сместится в сторону, уменьшающую это воздействие.
Так, повышение температуры экзотермической реакции сместит равновесие в сторону образования исходных веществ, понижение – в сторону образования продуктов. Увеличение давления в газофазной реакции, сместит равновесие в сторону меньших объемов газообразных веществ, понижение давления – в сторону больших объемов. Объемы газообразных веществ равны коэффициентам в уравнении реакции. Увеличение концентрации газа смещает равновесие в сторону, обратную увеличению.
Рассмотрим данные процессы.
2СО(г) Û СО2(г) + С(к); DНo = 119 кДж
Так как изменение энтальпии процесса положительно, то реакция протекает c поглощением тепла, то есть является эндотермической. Следовательно, в соответствии с принципом Ле-Шателье, повышение температуры сместит равновесие в сторону образования продуктов, то есть прямой реакции.
Реакция является гетерогенной, в ходе реакции объем газообразных веществ системы уменьшается (так как уменьшается их число моль; 2 моль СО в исходных веществах и 1 моль газов в продуктах), следовательно, в соответствии с принципом Ле-Шателье, понижение давления сместит равновесие в сторону обратной реакции.
Константа равновесия процесса запишется:
Кр = [CO2] / [CO]2
MgCO3(к) Û MgO(к) + CO2(г); DНo = 385 кДж
Так как изменение энтальпии процесса положительно, то реакция протекает c поглощением тепла, то есть является эндотермической. Следовательно, в соответствии с принципом Ле-Шателье, повышение температуры сместит равновесие в сторону образования продуктов, то есть прямой реакции.
Реакция является гетерогенной, в ходе реакции объем газообразных веществ системы увеличивается (нет газов в исходных веществах и 1 моль газов в продуктах), следовательно, в соответствии с принципом Ле-Шателье, понижение давления сместит равновесие в сторону прямой реакции.
Константа равновесия процесса запишется:
Кр = [CO2]
7. Может ли CaO обеспечить удаление серы из расплавленного чугуна при 10000С (закрытая система)?
2CaO + 1,5S2 = 2CaS + SO2
Термодинамические данные
|
Вещество |
DНo298, кДж/моль |
S0298, Дж/(моль·К) |
|
S2 |
+129,6 |
227,4 |
|
CaS |
- 462,0 |
56,7 |
|
CaO |
- 633,3 |
39,7 |
|
SO2 |
-296,5 |
247,6 |
О возможности применения оксида кальция для удаления серы можно судить по знаку изменения энергии Гиббса данной реакции.
Если ∆G < 0, самопроизвольное протекание реакции возможно, если ∆G > 0, самопроизвольное протекание реакции невозможно.
Изменение энергии Гиббса процесса рассчитывается по уравнению изотермы:
∆rG0= ∆rН0 - T∆rS0
Изменение энтропии и энтальпии реакции при стандартных условиях рассчитываем по следствию закона Гесса:
Тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции, минус сумма энтальпий образования исходных веществ, с учетом всех стехиометрических коэффициентов. Стандартные энтальпии образования простых веществ равны 0.
Для данной реакции получим:
∆rН0298 = (2DH0f,298(CaS т) + DH0f,298 (SO2 г)) – (2DH0f,298 (CaO т) + 1,5DH0f,298 (S2 г))
Δr S0298 = (2S0f,298(CaS т) + S0f,298 (SO2 г)) – (2S0f,298 (CaO т) + 1,5S0f,298 (S2 г))
Подставляя данные стандартных энтальпий и энтропий образования всех веществ, находим изменение энтальпии и энтропии реакции при 2980К:
∆rН0298 = (- 2*462,0 – 296,5) – (- 2*633,3 + 1,5*129,6) = - 1220,5 + 1072,2 = - 148,3 кДж =
= - 148300 Дж
Δr S0298 = (2*56,7 + 247,6) – (2*39,7 + 1,5*227,4) = 361 – 420,5 = - 59,5 Дж/К
Считая изменение энтальпии и энтропии независящими от температуры, находим изменение энергии Гиббса процесса при Т = 10000К:
∆rG01000 = ∆rН0298 - T∆rS0298 = - 148300 + 1000*59,5 = -88800 Дж = - 88,8 кДж.
Так как изменение энергии Гиббса процесса < 0, следовательно, данный процесс может протекать самопроизвольно в прямом направлении при данных условиях, значит оксид кальция может обеспечить удаление серы из чугуна.
8. Качественно охарактеризовать возможность протекания реакции при низких и высоких температурах:
BeCO3(к) = BeO(к) + CO2(г) .
О знаке изменения энтропии и энтальпии процессов можно судить по уравнению реакции, исходя из определений данных параметров.
Энтропия системы есть мера неупорядоченности системы, то есть энтропия всегда возрастает при переходе вещества из одного агрегатного состояния в другое, причем в направлении тв. à жидкость à газ. Энтропия всегда уменьшается при переходе аллотропных модификаций друг в друга, причем уменьшение происходит при переходе к более упорядоченной структуре. Энтропия системы всегда возрастает с образованием более простых веществ из сложного вещества, энтропия системы всегда возрастает при образовании большего числа моль продуктов реакции, чем исходных веществ.
Энтальпия системы – ее энергетическая функция, определяющая теплосодержание системы, то есть ее энергетический фактор. Энтальпии образования простых веществ равны 0, Энтальпии образования малореакционных соединений всегда << 0, реакционных, малоустойчивых и активных (химически) веществ, всегда больше энтальпий образования малореакционных соединений.
Проанализируем данную реакцию.
Данная реакция является гетерогенной и протекает с увеличением числа моль продуктов, причем в продуктах реакции имеется газообразное вещество. Следовательно, изменение энтропии реакции резко положительно, ∆S0 > 0.
Карбонат бериллия является достаточно стабильным устойчивым веществом, следовательно реакция его разложения (как и большинство реакций разложения) требует затрат энергии из-вне. Следовательно, изменение энтальпии в данной системе будет положительно, необходимы затраты энергии.
Получаем:
∆S0 > 0, ΔН0 > 0.
Изменение энергии Гиббса рассчитывается:
∆G0 = ∆Н0 - T∆S0
Очевидно, что, математически, при ∆S0 > 0, ΔН0 > 0, знак ∆G0 будет зависеть только от температуры реакции. Так как изменение энтальпии и изменение энтропии отличаются между собой на 3 порядка (1000 или кДж и Дж), то при низких температурах решающим фактором будет являться энтальпийный, а, значит изменение энергии Гиббса будет иметь знак «+», что говорит о невозможности самопроизвольного протекания реакции при низкой температуре.
При высоких температурах решающим фактором становится энтропийный фактор (T∆S0), следовательно, при определенном значении Т энергия Гиббса будет менять знак на противоположный, то есть будет принимать отрицательные значения, ∆G0 < 0.
Соответственно, при высоких температурах самопроизвольное протекание реакции возможно.
9. Окислительно-восстановительные реакции выражаются схемами:
KMnO4 + Na2SO3 + H2O → Na2SO4 + MnO2 + KOH
PbS + HNO3 → Pb(NO3)2 + S + NO + H2O
Методом электронного баланса подобрать коэффициенты в уравнениях реакций. Указать окислитель и восстановитель, процессы окисления и восстановления.
а) Определим элементы, изменившие степени окисления:
KMn+7O4 + Na2S+4O3 + H2O → Na2S+6O4 + Mn+4O2 + KOH
Как видно, это марганец и сера. Составляем электронный баланс:
Mn+7 + 3e = Mn+4 |2 окислитель, восстанавливается
S+4 – 2e = S+6 |3 восстановитель, окисляется.
Полученные коэффициенты подставляем в схему реакции и окончательно уравниваем:
2KMnO4 + 3Na2SO3 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
б) Определим элементы, изменившие степени окисления:
PbS-2 + HN+5O3 → Pb(NO3)2 + S0 + N+2O + H2O
Как видно, это азот и сера. Составляем электронный баланс:
N+5 + 3e = N+2 |2 окислитель, восстанавливается
S-2 – 2e = S0 |3 восстановитель, окисляется.
Полученные коэффициенты подставляем в схему реакции и окончательно уравниваем:
3PbS + 8HNO3 → 3Pb(NO3)2 + 3S + 2NO + 4H2O
10. Разобрать работу гальванического элемента, который описывается схемой:
Zn | Zn(NO3)2 || Pb(NO3)2 | Pb CZn2+ = 10-2 моль/л CPb2+ = 1 моль/л
Написать электронные уравнения анодного и катодного процессов, составить ионное уравнение окислительно-восстановительной реакции в гальваническом элементе и вычислить его ЭДС.
В гальваническом элементе катодом является тот электрод, потенциал которого больше.
Равновесный окислительно-восстановительный потенциал электрода рассчитывается по уравнению Нернста:
φ = φ0 + (RT/zF)*ln(Ox/Red) где φ0 – стандартный электродный потенциал, R – универсальная газовая постоянная 8,314 Дж/моль*К, Т – температура, F – постоянная Фарадея, 96485 Кл/моль, z – число электронов. Ох – концентрация окисленной формы, Red – концентрация восстановленной формы.
Для расчета потенциала металлического электрода опущенного в раствор собственной соли при стандартных условиях уравнение Нернста записывается:
φ = φ0 + (0,0592/z)*lg(Cм) где φ0 – стандартный окислительно-восстановительный потенциал металла, z – число принимаемых или отдаваемых электронов, См – молярная концентрация ионов металла в растворе.
Запишем стандартные потенциалы электродов:
φ0(Pb2+/Pb) = - 0,126 В
φ0(Zn2+/Zn) = - 0,762 В
Подставляя данные концентраций ионов, рассчитываем равновесные потенциалы электродов:
φ(Pb2+/Pb) = - 0,126 + (0,0592/2)*lg(1) = - 0,126 В.
φ(Zn2+/Zn) = - 0,762 + (0,0592/2)*lg(10-2) = - 0,762 – 0,0592 = - 0,8212 В.
Сравнивая значения потенциалов, видно, что анодом является цинковый электрод, катодом – свинцовый.
Схема гальванического элемента запишется:
А(-) Zn | Zn2+ || Pb2+ | Pb (+) К
На катоде протекает процесс восстановления катионов свинца:
Pb2+ + 2e = Pb0
На аноде – процесс окисления цинка:
Zn0 – 2e = Zn2+
Суммарное уравнение запишется:
Pb2+ + Zn0 = Pb0 + Zn2+
ЭДС гальванического элемента равна разнице потенциалов катода и анода:
Е = φк – φА = - 0,126 – ( - 0,8212) = 0,6952 В.
11. Как протекает коррозия в случае повреждения поверхностного слоя оцинкованного и
никелированного железа при их контакте с водой? При решении задачи составить схему коррозионной гальванопары и указать направление движения электронов. Написать электронное суммарное уравнение процесса электрохимической коррозии.
Термодинамическую возможность коррозии оценивают путем сравнения потенциалов каждого из металлов с потенциалами водородного и кислородного электродов. Если потенциал металла меньше потенциала водородного или кислородного электрода, то коррозия термодинамически возможна, если потенциал металла больше – соответственно, наоборот.
При контакте с водой (присутствует кислород) возможна коррозия с кислородной деполяризацией на катоде.
При кислородной деполяризации потенциал кислородного электрода равен:
φ = 1,229 – 0,059рН + 0,0147*lgРО2
При стандартном давлении 1 атм и рН = 7 потенциал кислородного электрода равен:
φ = 1,229 – 0,059рН = 1,229 – 0,059*7 = 0,816 В
Корродировать в данной среде могут металлы, потенциал которых меньше данного потенциала кислородного электрода.
При покрытии железа никелем (никелированное железо) и цинком (оцинкованное железо) аозникают гальванопары:
Zn-Fe и Ni-Fe.
Запишем стандартные потенциалы металлов в обеих парах:
(Ni2+/Ni) = - 0,25 В
(Fe2+/Fe) = - 0,44 В
(Zn2+/Zn) = - 0,763 В
(Fe2+/Fe) = - 0,44 В
Сравнивая потенциалы всех металлов с потенциалом кислородного электрода, видно, что возможна коррозия всех металлов.
Рассмотрим каждый случай.
а) При нарушении покрытия возникает гальванический элемент Ni-Fe. Так как потенциал железа меньше потенциала никеля, то железо выступает в роли анода, никель – в роли катода. Предпочтительнее коррозия железа.
На аноде происходит окисление металла анода:
А: Fe – 2e = Fe2+
На катоде – процесс поглощения кислорода:
K: 2H2O + O2 + 4e = 4OH-
Суммарный процесс коррозии:
2Fe + 2H2O + O2 = Fe(ОН)2
И дальнейшее окисление гидроксида железа (II) с образованием ржавчины:
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Fe(OH)3 = FeO(OH) + H2O
ржавчина
Таким образом, при нарушении покрытия (никеля), начинается процесс коррозии железа.
Направление движения электронов во внешней цепи от анода к катоду:
![]() Fe | H2O, O2 |Ni
Fe | H2O, O2 |Ni
e
б) При нарушении покрытия возникает гальванический элемент Zn-Fe. Так как потенциал цинка меньше то он выступает в роли анода, железо – в роли катода.
На аноде происходит окисление металла анода:
А: Zn – 2e = Zn2+
На катоде – процесс поглощения кислорода:
K: 2H2O + O2 + 4e = 4OH-
Суммарный процесс коррозии:
2Zn + 2H2O + O2 = Zn(ОН)2
Таким образом, в данном случае железо не подвергается коррозии, пока не прокорродирует весь цинк.
Направление движения электронов во внешней цепи от анода к катоду:
![]() Zn | H2O, O2 |Fe
Zn | H2O, O2 |Fe
e
12. В промышленности хлор получают электролизом концентрированного раствора хлорида натрия. Написать уравнения электродных процессов, протекающих при электролизе этого раствора с угольными электродами.
При электролизе, растворов на катоде в первую очередь протекает тот процесс, потенциал которого больше.
Хлорид натрия в растворе полностью диссоциирует:
NaCl = Na+ + Cl-
При электролизе водного раствора хлорида натрия, в прикатодном пространстве накапливаются катионы натрия и молекулы воды.
Сравним потенциалы восстановления натрия и восстановления водорода из воды:
φ0(H2O/H2, OH-) = - 0,83 В. > φ0(Na+/Na) = - 2,714 В
Следовательно, на катоде протекает процесс разложения воды и выделения водорода:
2Н2О – 2е = Н2 + 2ОН-
В прианодном пространстве накапливаются хлорид-ионы и молекулы воды.
На аноде разряжаются (окисляются) те ионы потенциал которых меньше:
Сравним потенциалы окисления хлорид-ионов и выделения кислорода из воды:
φ0(О2, H+/H2O) = 1,23В < φ0(2Сl–/Cl2) = 1,35 В
Но, из-за величины перенапряжения на аноде и кинетической затрудненности разложения воды на аноде всегда (в таких случаях) происходит выделение хлора:
На аноде протекает процесс:
2Cl- - 2e = Cl2
Суммарно, процесс электролиза запишется:
эл.ток
2NaCl + 2H2O = 2NaOH + H2 + Cl2
13. Объяснить с точки зрения строения атомов, что металлы как простые вещества обладают только восстановительными свойствами.
Металлы - это простые вещества, атомы которых могут только отдавать электроны. Такая особенность металлов связана с тем, что на внешнем уровне этих атомов мало электронов (чаще всего от 1 до 3) или внешние электроны расположены далеко от ядра. Чем меньше электронов на внешнем уровне атома и чем дальше они расположены от ядра, - тем активнее металл (ярче выражены его металлические свойства). Это свойство характеризуется понятием «потенциал ионизации» или ионизационный потенциал. Он представляет собой характеристику энергии ионизации, то есть той энергии, которую необходимо приложить к атому, чтобы «оторвать» электрон и перевести атом в катион. Как известно, любой атом стремится перейти в наиболее стабильное состояние. Таких стабильных состояния атома может быть 2:
Полностью заполненный энергетический уровень (октет электронов) и энергетический уровень на котором нет электронов. Так как атомы металлов имеют от 1 до 3 электронов, им всегда энергетически выгоднее отдавать электроны для перехода в стабильное состояние с полностью свободным энергетическим уровнем, то есть проявлять восстановительные свойства. Принимать электроны атомам металлов энергетически очень невыгодно, следовательно металлы в обычном состоянии не проявляют свойств окислителей.
14. Медь не взаимодействует в разбавленной серной кислотой, но растворяется в концентрированной кислоте. В чем причина наблюдаемого явления? Составить уравнение соответствующей реакции, а также написать реакции взаимодействия меди с разбавленной и концентрированной HNO3? При решении задачи коэффициенты в уравнениях реакций подобрать методом электронного баланса.
Медь в ряду напряжений металлов стоит правее водорода, то есть имеет стандартный окислительно-восстановительный потенциал больше потенциала восстановления водорода:
φ0(Cu2+/Cu0) = + 0,337 В. > φ0(2H+/H2) = 0 В.
Таким образом, медь не может вытеснять водород из растворов кислот, так как все окислительно-восстановительные процессы могут протекать в случае, если ЭДС процесса положительна.
Допустим медь вытесняет водород. Тогда, медь – восстановитель, водород – окислитель:
Cu0 – 2e = Cu+2 восстановитель
2H+ + 2e = H2 окислитель
ЭДС процесса равна разнице потенциалов окислителя и восстановителя:
Е = φок – φвосст = 0 – 0,337 = - 0,337 В.
Как видно, ЭДС < 0, следовательно процесс протекать не может. Таким образом, медь не может вытеснять водород из растворов кислот. Раствор серной кислоты – как раз раствор кислоты в котором только катионы водорода могут быть окислителями.
В концентрированной серной кислоте окислителем выступает уже сульфат-ион, который восстанавливается до диоксида серы:
SO42- + 4H+ = SO2 + H2O
φ0(SO42-/SO2) = + 0,172 В.
Но, в концентрированной серной кислоте этот потенциал намного выше (около 1 В), так как он зависит от концентрации ионов Н+.
Таким образом, концентрированная серная кислота растворяет медь с выделением диоксида серы:
Cu + 2H2SO4(конц) → CuSO4 + SO2↑ + 2H2O
Cu0 – 2e = Cu+2 |1 восстановитель
S+6 + 2e = S+4 |1 окислитель
Азотная кислота всегда обладает окислительными свойствами за счет нитрогруппы, и практически никогда – за счет катионов водорода.
Концентрированная азотная кислота растворяет медь, восстанавливаясь до оксида азота (IV):
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Cu0 – 2e = Cu+2 |1 восстановитель
N+5 + 1e = N+4 |2 окислитель
Разбавленная азотная кислота в данной реакции восстанавливается до оксида азота(II):
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu0 – 2e = Cu+2 |3 восстановитель
N+5 + 3e = N+2 |2 окислитель
15. Указать степень окисления и координационное число комплексообразователя в следующих соединениях: [Cd(NH3)6]SO4 , K3[Fe(CN)6]. Написать уравнения реакций их диссоциации и выражения для констант нестойкости комплексных ионов, зная, что константы нестойкости соответственно равны 7,3*10-6, 1*10-31. Указать, какой из комплексных ионов является более прочным. Назвать соединения.
[Cd(NH3)6]SO4 – сульфат гексаамминкадмия.
В данном комплексном соединении комплексообразователем является катион кадмия в степени окисления +2, Cd+2. Молекулы аммиака являются монодентатными лигандами, всего таких лигандов 6, координационное число комплексообразователя равно 6.
В водном растворе он диссоциирует как сильный электролит на внешнюю и внутреннюю сферы:
[Cd(NH3)6]SO4 = [Cd(NH3)6]2+ + SO42-
Комплексный ион также диссоциирует, но как слабый электролит, ступенчато:
1-я ступень:
[Cd(NH3)6]2+ = [Cd(NH3)5]2+ + NH3
2-я ступень:
[Cd(NH3)5]2+ = [Cd(NH3)4]2+ + NH3
3-я ступень:
[Cd(NH3)4]2+ = [Cd(NH3)3]2+ + NH3
4-я ступень:
[Cd(NH3)3]2+ = [Cd(NH3)1]2+ + NH3
5-я ступень:
[Cd(NH3)2]2+ = [Cd(NH3)]2+ + NH3
6-я ступень:
[Cd(NH3)]2+ = Cd2+ + NH3
Суммарное уравнение диссоциации комплексного иона:
[Cd(NH3)6]2+ = [Cd(NH3)5]2+ + NH3
Константа нестойкости комплексного иона запишется:
Кн = [NH3]6*[Cd] / [[Cd(NH3)6]2+]
K3[Fe(CN)6] – гексацианоферрат (III) калия.
В данном комплексном соединении комплексообразователем является катион железа в степени окисления +3, Fe+3. Цианид-ионы являются монодентатными лигандами, всего таких лигандов 6, координационное число комплексообразователя равно 6.
В растворе гексацианоферрат (III) калия диссоциирует как сильный электролит:
Первичная диссоциация:
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
Комплексный ион диссоциирует частично, как слабый электролит:
Вторичная диссоциация:
1-я ступень:
[Fe(CN)6]3- = [Fe(CN)5]2- + CN-
2-я ступень:
[Fe(CN)5]2- = [Fe(CN)4]- + CN-
3-я ступень:
[Fe(CN)4]- = [Fe(CN)3]0 + CN-
4-я ступень:
[Fe(CN)3]0 = [Fe(CN)2]+ + CN-
5-я ступень:
[Fe(CN)2]+ = [Fe(CN)]2+ + CN-
6-я ступень:
[Fe(CN)]2+ = Fe3+ + CN-
Суммарная диссоциация комплексного иона:
[Fe(CN)6]3- = Fe3+ + 6CN-
Константа нестойкости запишется:
Кн = [Fe3+]*[CN-]6 / [[Fe(CN)6]3-]
Комплексные ионы характеризуются константой нестойкости (КН) то есть величиной показывающей величину диссоциации того или иного комплекса. Чем больше константа нестойкости Кн тем менее прочный комплекс. Также часто используется величина константы устойчивости (β), которая обратнопропорциональна константе нестойкости:
β = 1/КН
Чем больше константу устойчивости, том прочнее комплексный ион.
Сравнивая значения констант нестойкости гексацианоферрат (III)-иона и катиона гексаамминкадмия, видно, что цианидный комплекс железа намного устойчивее чем аммиачный комплекс кобальта:
Кн([Fe(CN)6]3-) = 1*10-31 << Кн([Cd(NH3)6]2+) = 7,3*10-6
