Пример решенной контрольной работы по химии на тему 'коррозия металлов'
Задание 1.
2. Написать уравнения электродных процессов в случае контакта металлов А и В, рассчитать ЭДС и энергию Гиббса образовавшегося гальванического элемента в указанных условиях. Стандартные потенциалы металлов приведены в приложении Б.
Металл А – Fe, Металл В – Sn. Условия коррозии - во влажной нейтральной атмосфере.
Решение:
Найдем, какой из двух металлов будет играть роль анода, для этого сравним их стандартные электродные потенциалы:
![]() ;
; ![]()
Металл, имеющий более отрицательную величину электродного потенциала, играет роль анода. В этом примере анодом будет железо, а олово будет катодом, накотором будет протекать процесс катодной деполяризации. В нейтральной влажной атмосфере протекает преимущественно кислородная деполяризация. Убедимся в ее термодинамической возможности, для чего вычислим потенциал кислородного электрода при рН =7 и парциальном давлении атмосферного кислорода О2 Р = 21кПа:
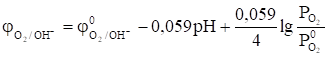 =
=
=+1,227-0,059·7+0,0147· lg(21000/101325) = + 0,804 В
![]() = +0,804 В >
= +0,804 В > ![]() , коррозия возможна.
, коррозия возможна.
Электродные процессы коррозии будут протекать следующим образом:
А: Fe - 2ē → Fe2+
K: O2+2H2O + 4ē → 4OH-
Суммарный процесс:
Fe + ½·O2+H2O → Fe2+ + 2OH-
ЭДС образовавшегося гальванического элемента вычислим по формуле Е = φк – φа = 0,804-(-0,44) = 1,244 В.
Для расчета энергии Гиббса воспользуемся формулой:
ΔG = –zFE,
где z – число участвующих в процессе электронов;
F – постоянная Фарадея;
Е – ЭДС, В.
Получим:
ΔG = –zFE = -2 · 96500 · 1,244 = -240092 Дж/моль ≈ -240,1 кДж.
Задание 2.
5. Рассмотреть диаграмму Пурбэ для указанного металла, указать уравнения всех возможных химических и электрохимических равновесий, зоны иммунности, коррозии и пассивности.
Металл – серебро.
Решение:
Рассмотрим диаграмму Пурбэ для серебра (рис.1).
|
|
|
|
|
|
|
|
|
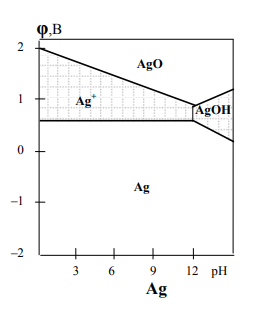
Рис. 1. Диаграмма Пурбэ для серебра
Линии диаграммы соответствуют следующим равновесиям:
1. Ag ↔ Ag+ + ē.
2. Ag+ + OH- ↔ AgOH
3. Ag + OH- ↔ AgOH + ē
4. AgOH +OH- ↔ AgO + H2O + ē
5. Ag+ + 2OH- ↔ AgO + H2O + ē
I – область термодинамической устойчивости (иммунности);
II, III – коррозия; III – область пассивности.
Области коррозии заштрихованы.
Пассивность зоны ІІІ объясняется образованием пленки AgO.
Задание 3.
3. Дать письменный ответ на вопрос в соответствии с вариантом задания (табл.4).
Кинетические уравнения скорости газовой коррозии
Ответ:
Скорость химической (газовой) коррозии определяют количественно по наблюдениям во времени за изменением какой-либо подходящей для этих целей величины, изменяющейся в процессе коррозии.
Тогда истинная скорость коррозии металлического материала определяется из выражения:
V = dy/dt,
где y - изменяющаяся в процессе коррозии характеристика свойства материала;
t - время коррозии.
Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением средней скорости коррозионного разрушения материала:
Vср=Dy/Dt.
Используется ряд показателей коррозии.
1.Глубинный показатель коррозии:
Kn=DП/Dt,
где DП - глубина (средняя или максимальная ) коррозионного разрушения;
t - время коррозии.
2. Показатель изменения толщины образующейся на металле пленки продуктов коррозии:
Kn=Dh/Dt,
где Dh - изменение толщины образующейся на металле пленки продуктов коррозии;
Dt - время коррозии.
3. Показатель изменения массы
Km=Dm/S*Dt,
где Dm - изменение массы корродирующего металла;
S - поверхность коррозии;
Dt - время коррозии.
4.Объемный показатель коррозии
Kv=DV/S*Dt,
где DV - объем газа, выделившегося или поглощенного в процессе коррозии и приведенный к нормальным условиям;
Dt - время коррозии;
S - поверхность коррозии.
5. Механический показатель коррозии.
Ks=(Ds/Dt)*100%,
где Ds - относительное изменение характеристики механического свойства;
Dt - время коррозии.
6. Показатель изменения электрического сопротивления.
KR=(DR/Dt)*100%,
где DR - относительное изменение электросопротивления образца;
Dt - время коррозии.
