Пример решенной контрольной работы по химии
Задание 12
1) По стандартным окислительно-восстановительным потенциалам определите направление протекания реакции в ст.у.
OH- + Cl2 + I- → Cl- + IO3- + H2O
Решение:
При взаимодействии двух сопряженных окислительно-восстановительных пар окислителем всегда будет окисленная форма той пары, потенциал которой имеет большее значение. Восстановителем будет восстановленная форма пары, имеющей меньшее значение потенциала.
Выписываем потенциалы сопряженных окислительно-восстановительных пар
![]()
![]()
Из сравнения потенциалов делаем вывод, что окислителем будет Cl2, восстановителем будет I-
Направление протекания реакции следующее
![]()
Проводим уравнивание
![]()
2) Подберите коэффициенты методом ионно-электронных уравнений для окислительно-восстановительной реакции
SnCl2 + KNO2 + HCl → SnCl4 + NO + KCl + H2O
Укажите окислитель и восстановитель.
Решение:
![]()
В ходе данной окислительно-восстановительной реакции степень окисления олова повышается от +2 до +4. Степень окисления азота понижается от +5 до +1.
Расставляем коэффициенты в уравнении реакции методом ионно-электронных уравнений. Записываем только молекулы и ионы, которые содержат атомы элементов, изменивших степени окисления.
![]()
Определяем среду, в которой протекает реакция. В данном случае среда – кислая. В полуреакции участвуют ионы водорода H+. Исходные ионы содержат больше атомов кислорода, чем продукты реакции, поэтому избыток атомов кислорода в кислой среде связывается ионами Н+ в молекулы воды.
Составляем ионно-молекулярное уравнение каждой полуреакции и уравниваем число атомов всех элементов.
![]()
![]() 1 Sn – восстановитель
1 Sn – восстановитель
![]() 2 KNO2 – окислитель
2 KNO2 – окислитель
Умножаем полученные уравнения на наименьшие множители, для баланса по электронам. Суммируем полученные электронно-ионные уравнения и получаем сокращенное ионно-молекулярное уравнение окислительно-восстановительной реакции.
![]()
Дополняем правую и левую части необходимым числом хлорид-ионов и ионов калия. Получаем полное ионно-молекулярное уравнение.
![]()
![]()
По полученному ионно-молекулярному уравнению составляем молекулярное уравнение.
![]()
3) Для гальванического элемента Co|Co2+ (0,5 моль/л)||Ni2+ (0,5 моль/л)|Ni
напишите катодный и анодный процессы, уравнение токообразующей реакции и вычислите ЭДС.
Решение:
Стандартные электродные потенциалы кобальта и никеля имеют следующие
потенциалы
![]()
![]()
Находим потенциалы электродов по уравнению Нернста
![]()
![]()
Поскольку ![]() , то кобальтовый электрод играет роль анода, никелевый электрод играет роль катода.
, то кобальтовый электрод играет роль анода, никелевый электрод играет роль катода.
Записываем катодный и анодный процессы,
![]()
![]()
Записываем уравнение токообразующей реакции
![]()
Находим ЭДС как разность потенциалов катода и анода.
![]()
![]()
4) Составить схему электролиза водного раствора MgSO4 на платиновых электродах с учетом всех возможных реакций на катоде и аноде.
Решение:
В водном растворе сульфат магния диссоциирует на ионы магния и сульфат-ионы
![]()
Поскольку неизвестная плотность тока, то принимаем перенапряжение водорода и кислорода на платине равным нулю.
(+) анод | (-) катод |
|
|
|
|
|
|
|
|
Из сравнения потенциалов полуреакций делаем вывод, что на аноде будет происходить окисление молекул воды, на катоде – восстановление молекул воды.
![]()
![]()
5. Как долго надо пропускать ток силой 2,5 А через расплав PbCl2, чтобы на катоде выделилось 20 г металла?
Решение:
Записываем уравнение реакции
![]()
Масса вещества, выделившегося на электроде, рассчитывается по уравнению Фарадея.
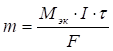
где:
![]() молярная масса эквивалентов вещества, г/моль.
молярная масса эквивалентов вещества, г/моль.
![]() сила тока, А;
сила тока, А;
![]() время электролиза, с;
время электролиза, с;
F - постоянная Фарадея (96500 Kл/моль).
Молярная масса эквивалентов свинца равна
![]()
Находим необходимое время электролиза
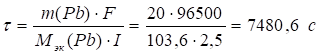
![]()
