Примеры решенных задач по физике - контрольная 4(молекулярная физика и термодинамика)
Ниже приведены условия и решения задач. Закачка решений в формате doc начнется автоматически через 10 секунд.
№ 504
Найти среднюю квадратичную, среднюю арифметическую и наиболее вероятную скорости молекул водорода. Вычисления выполнять для температуры 300 К.
Дано: Т = 300 К.
Найти: ![]() ,
, ![]() , Vв.
, Vв.
Решение.
Средняя арифметическая скорость молекул выражается формулой
![]() =
= ![]() (1)
(1)
где Т- температура газа ; R- молярная газовая постоянная [R=8,31 Дж/(моль К)] ; M- моляр- ная масса газа (для водорода М=0,002 кг/моль).
Средняя квадратическая скорость молекулы газа выражается формулой:
![]() =
=![]() (2)
(2)
Наиболее вероятная скорость молекул газа:
Vв = ![]() (3)
(3)
Находим:
![]() =
= 1781,6 м/с;
1781,6 м/с;
![]() =
=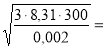 1933,8 м/с;
1933,8 м/с;
Vв=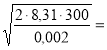 1578,9 м/с.
1578,9 м/с.
№ 514.
Определить молярную массу газа, если при температуре Т=300 К и давлении p=0,2 МПа он имеет плотность ρ=2,41 кг/м3.
Дано : T= 300 K
P= 2×105 Па
ρ=2,41 кг/м3
Найти: Решение.
Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, записанного в виде:
P=![]() (1) , где ρ – плотность газа; R – молярная газовая постоянная (R =8.31 Дж/(моль∙К)) ; T – температура газа ; P – давление газа ; μ – молярная масса газа.
(1) , где ρ – плотность газа; R – молярная газовая постоянная (R =8.31 Дж/(моль∙К)) ; T – температура газа ; P – давление газа ; μ – молярная масса газа.
Выражая из (1) молярную массу μ, получим :
=![]() (3)
(3)
Подставляя, заданные числовые значения физических величин в формулу (3) и вычисляя, получим :
=![]() =0,03 кг/моль
=0,03 кг/моль
Ответ : =0,03 кг/моль.
№ 524
Найти отношения теплоёмкостей Cp/Cv для газовой смеси, состоящей из 10 г гелия и 25 г водорода?
Дано: газ He
газ Н2
ν1= m1/M1 = 10/4 =2,5 моль
ν2= m2/M2 = 25/2 = 12,5 моль
Найти : Cp/Cv Решение.
Молярную теплоёмкость смеси Cv при постоянном объёме найдём следующим. Теплоты, необходимую для нагревания смеси на ΔТ, выразим двумя способами :
Q=Cv(ν1+ν2)ΔT (1)
Q=(Cv1ν1+Cv2ν2)ΔT (2)
где Cv1 – молярная теплоёмкость гелия ; Cv2 – молярная теплоёмкость кислорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на ΔТ, получим :
Cv(ν1+ν2)=Cv1ν1+Cv2ν2 , откуда
Cv=(Cv1ν1+Cv2ν2)/(ν1+ν2) (3)
Рассуждая так же, получим формулу для вычисления молярной теплоёмкости при постоянном давлении :
Cp=(Cp1ν1+Cp2ν2)/(ν1+ν2) (4)
Вычислим отношение формул (4) и (3), получим :
Cp/Cv=(Cp1ν1+Cp2ν2)/(Cv1ν1+Cv2ν2) (5)
Молярные теплоёмкости газа при постоянном объёме и давлении выражаются соответственно :
Cv=iR/2 ; Cp=(i+2)R/2 , где i – число степеней свободы молекулы газа.
Используя эти выражения запишем формулы для молярных теплоёмкостей гелия и кислорода.
Сv1=i1R/2 (6) ; Cp1=(i1+2)R/2 (7) ,где i1=3 (так как молекула гелия одноатомная).
Сv2=i2R/2 (8) ; Cp2=(i2+2)R/2 (9) , где i2=5 (так как молекула водорода двухатомная).
Подставляя, полученные выражения (6), (7), (8) и (9) в формулу (5), получим :
Cp/Cv=[(i1+2)ν1+(i2+2)ν2]/(i1ν1+i2ν2) (10)
Произведя вычисления, получим :
Cp/Cv=[(3+2)∙2,5+(5+2)∙12,5]/(3∙2,5+5∙12,5)= 1,4286 Дж/(К моль)
Ответ : Cp/Cv=1,4286 Дж/(К моль).
№534
Найти среднюю длину свободного пробега молекулы азота в сосуде объемом 6 л. Масса газа 0,5 г.
Дано : d=3×10-8 см=3×10-11 см
p=105 Па
T=273 K
Найти : ![]()
Решение.
Средняя длина свободного пробега молекул газа выражается формулой :
![]() =1/
=1/![]() πd2n (1)
πd2n (1)
где d – диаметр молекулы ; n – концентрация молекул.
Концентрация молекул связана с давлением и температурой газа выражением:
n=p/kT (2)
где к – постоянная Больцмана (к=1.38×10-23 Дж/К)
Из уравнения Менделеева-Клайперона можем записать:
![]() (3)
(3)
, где V – объем газа, R – молярная газовая постоянная, m и M – масса и молярная масса газа соответственно.
Подставляя (3) в (2), а затем в выражение (1), получим:
![]() =
=![]() (4)
(4)
Вычисления по формуле (4) дают
![]() =
=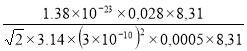 = 1,9336×10-3 м
= 1,9336×10-3 м
Ответ: ![]() =1,9336×10-3 м.
=1,9336×10-3 м.
№ 546
Газ, для которого γ=Cp/Cv=4/3, находится под давлением P=2×105 Па и занимает объём V=3 дм3. В результате изобарического нагревания объём увеличился в 3 раза. Определить количество теплоты, переданное газу.
Дано : γ=Cp/Cv=4/3
P=2×105 Па
V=3 дм3=3×10-3 м3
V2/V=3
Найти : Q
Решение.
Количество теплоты, участвующее в изобарном процессе выражается формулой :
Q=![]() (1) , где m – масса газа ; M – молярная масса газа ; Cp – молярная теплоёмкость при p=const ; ΔT – изменение температуры газа.
(1) , где m – масса газа ; M – молярная масса газа ; Cp – молярная теплоёмкость при p=const ; ΔT – изменение температуры газа.
Изменение температуры газа :
ΔT=T2-T1 (2)
Начальную Т1 и конечную Т2 температуры газа найдём из уравнения Менделеева-Клапейрона :
T1=![]() (3) ; T2=
(3) ; T2=![]() (4)
(4)
где V и V2 – объёмы газа до нагревания и после, соответственно.
С учётом выражений (3) и (4), формула (2) примет вид :
ΔT=![]() (5)
(5)
Подставляя полученное выражение для ΔТ согласно (5) в уравнение (1), получим :
Q=![]() (6)
(6)
С учётом уравнения : R=Cp-Cv выражение (6) примет вид :
Q=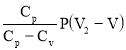
Разделив числитель и знаменатель последнего выражения на Cv и, учитывая, что V2=3V, получим :
Q=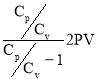 (7)
(7)
Произведя вычисления по формуле (7), найдём количество теплоты, подведённое к газу :
Q=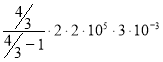 =4800 Дж=4.8 кДж
=4800 Дж=4.8 кДж
Ответ : Q=4.8 кДж.
№ 556
Во сколько раз необходимо увеличить объём ν=5 моль идеального газа при изотермическом расширении, если его энтропия увеличилась на ΔS=57.6 Дж/К?
Дано : ν=5 моль
T=const
ΔS=57.6 Дж/К
Найти : V2/V1
Решение.
Как известно, изменение энтропии выражается общей формулой :
ΔS=S2-S1=![]() (1)
(1)
При вычислении по формуле (1) вынесем температуру Т за знак интеграла (при изотермическом процесс T=const). Вычислив интеграл, найдём :
ΔS=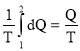 (2)
(2)
где Q – количество теплоты.
Количество теплоты при изотермическом процессе выражается формулой :
Q=νRTln(V2/V1) (3)
С учётом (2) уравнение (3) примет вид :
ΔS=![]()
Отсюда изменение объёма газа :
V2/V1=![]() (4)
(4)
Вычисления по формуле (4) дают :
V2/V1=![]() =4
=4
Ответ : объём газа необходимо увеличить в 4 раза.
Имя файла: Physics4.doc
Размер файла: 108.5 Kb
Если закачивание файла не начнется через 10 сек, кликните по этой ссылке
