Примеры решенных задач по химии - 3
№6
Решение:
1) w(O) = 22,56%
формула оксида MnxOy
x:y = n(Mn):n(O)
Пусть масса MnxOy равна 100 г, тогда
m(O) = w(O)∙m(MnxOy) = 0,2256∙100 = 22,56 г
m(Mn) = m(MnxOy) – m(O) = 100 – 22,56 = 77,44г
n(Mn) = m(Mn)\M(Mn) = 77,44г\55г\моль = 1,4 моль
n(O) = m(O)\M(O) = 22,56г\16г\моль = 1,4 моль
x:y = 1,4:1,4 = 1:1
MnO – формула оксида.
2) w(O) = 50,50%
формула оксида MnaOb
a:b = n(Mn):n(O)
Пусть масса MnaOb равна 100 г, тогда
m(O) = w(O)∙m(MnaOb) = 0,5050∙100 = 50,50 г
m(Mn) = m(MnaOb) – m(O) = 100 – 50,50 = 49,50 г
n(Mn) = m(Mn)\M(Mn) = 49,50г\55г\моль = 0,9 моль
n(O) = m(O)\M(O) = 50,50г\16г\моль = 3,16 моль
a:b = 0,9:3,16 = 1:3,5 = 2:7
Mn2O7 – формула оксида.
№38
Решение:
По уравнению Клапейрона-Менделеева:
pV = nRT
p = nRT\V
n(N2) = m(N2)\M(N2) = 5000г/28г/моль = 178,6 моль
р = 178,6моль∙0,082(л∙атм/моль∙К)∙773К/20л= 566 атм
№54
HMnO4 – Mn2O7
H3BO3 – B2O3
HNO3 – N2O5
HNO2 – N2O3
H3AsO4 – As2O5
HPO3 – P2O5
H3PO4 – P2O5
H2CO3 – CO2
№71
Порядковый номер 23, элемент – ванадий.
Электронная формула: 1s22s22p63s23p64s23d3
V относится к семейству d-элементов.
Квантовые числа последнего электрона: главное квантовое число n = 3, орбитальное квантовое число l = 2, магнитное квантовое число ml = 0, спиновое квантовое число ms = +1\2
Порядковый номер 33, элемент – мышьяк .
Электронная формула: 1s22s22p63s23p64s23d104р3
As относится к семейству p-элементов.
Квантовые числа последнего электрона: главное квантовое число n = 4, орбитальное квантовое число l = 1, магнитное квантовое число ml = -1, спиновое квантовое число ms = +1\2
№83
Электроотрицательность – мера способности атомов притягивать к себе общую электронную пару при образовании химической связи.
Для р-элементов по периодам с увеличением порядкового номера (слева направо) электроотрицательность увеличивается, по группам с увеличением порядкового номера (сверху вниз) – уменьшается.
№113
Ионная связь – химическая связь, обусловленная электростатическим взаимодействием противоположно заряженных ионов.
Свойства, отличающие ионную связь от ковалентной, - ненаправленность и ненасыщаемость.
Типичные ионные соединения: CsF, NaCl, KF и др.
№168
Решение:
По уравнению Вант-Гоффа:
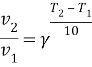
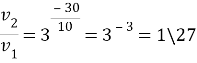
Скорость реакции уменьшится в 27 раз.
№197
Решение:
m1(p-pa NaCl) = 300г
w1(NaCl) = 20%
m2(p-pa NaCl) = 500г
w2(NaCl) = 40%
w3(NaCl) = ?
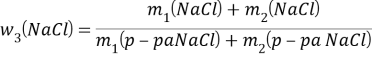
![]()
![]()
![]()
№124
Решение:
2H2S(г) + H2S(г) = 2H2O(г) + CS2(г)
Справочные данные:
|
|
H2S(г) |
CO2(г) |
H2O(г) |
CS2(г) |
|
|
-20,15 |
-393,51 |
-241,84 |
115,3 |
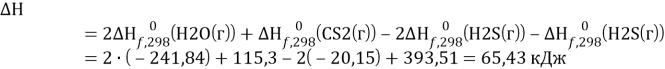
Термохимическое уравнение:
2H2S(г) + H2S(г) = 2H2O(г) + CS2(г) - ![]()
№145
а) переход воды в пар
энтропия при переходе воды в пар увеличивается, т к увеличивается неупорядоченность системы.
![]()
б) переход графита в алмаз
энтропия при переходе графита в алмаз уменьшается, т к алмаз более упорядочен, чем графит.
![]()
При фазовых превращениях энтропия увеличивается при переходе от кристаллического состояния к жидкости и от жидкости к газу. При аллотропических превращениях энтропия увеличивается при переходе от более упорядоченных к менее упорядоченным системам.
№220
Решение:
Ткип(раствора) = Ткип(воды) + ΔТ
ΔТ = E∙Cm
![]()
Пусть масса раствора С3Н7ОН равна 1000 г, тогда ![]()
![]()

ΔТ = 0,52∙2,94=1,520С
Ткип(раствора) = 100+1,52= 101,520С
Контрольная работа №2
№235
Решение:
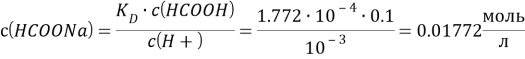
![]()
![]()
№246
[OH-] = Kw/[H+]
а) 10ˉ³ моль/л
[OH-] = 10-14/10-3 = 10-11
б) 6.5·10-8 моль/л
[OH-] = 10-14/6.5·10-8 = 0,15∙10-6 моль/л
№275
Решение:
![]()
M(Ag3PO4) = 3∙108+31+4∙16=419 г/моль
![]()
Ag3PO4 → 3Ag+ + PO43-
По уравнению реакции получаем, что с(Ag+) = 3c(Ag3PO4) = 4.8∙10-5 моль/л, с(PO43-) = c(Ag3PO4) = 1,6∙10-5 моль/л.
ПР = с(Ag+)3∙ с(PO43-) = (4.8∙10-5)3∙1,6∙10-5 = 1,8∙10-18
№283
Zn²+ + H2S = ZnS↓ + 2H+
Zn²+ + 2Сl- + H2S = ZnS↓ + 2H+ + 2Сl-
ZnCl2 + H2S = ZnS + 2HCl
Mg²+ +CO3²ֿ = MgCO3↓
Mg2+ + SO42- + 2Na+ + CO32- = MgCO3 + SO42- + 2Na+
MgSO4 + Na2CO3 = MgCO3 + Na2SO4
H+ + OH- = H2O
H+ + Cl- + Na+ + OH- = H2O + Cl- + Na+
HCl + NaOH = H2O + NaCl
№312
Уравнение гидролиза:
2СuSO4 + 2K2CO3 + H2O = (CuOH)2CO3 + CO2 + 2K2SO4
2Cu2+ + 2SO42- + 4K+ + 2CO32- + H2O = (CuOH)2CO3 + CO2 + 4K+ + 2SO42-
2Cu2+ + 2CO32- + H2O = (CuOH)2CO3 + CO2
№335
Окислительно-восстановительные реакции:
5P-3H3 + 8KMn+7O4 + 12H2SO4 → 5H3P+5O4 + 4K2SO4 + 8Mn+2SO4 + 12H2O
P-3 -8e = P+5 5 восстановитель
Mn+7 +5e = Mn+2 8 окислитель
3Cu+2O + 2N-3H3→3Cu0 + N20↑ + 3H2O
Cu+2 +2e = Cu0 3 окислитель
2N-3 - 6e = N20 1 восстановитель
№345
Решение:
EMn2+/Mn = E0Mn2+/Mn + ( 0,059 / z ) ∙ lg [ Mn2+ ]
lg [Mn2+] = (EMn2+/Mn - E0Mn2+/Mn) ∙z / 0,059
E0Mn2+/Mn = -1.179 В (справочная величина)
lg [Mn2+] = (-1,23-(-1,179)) ∙2 / 0,059 = -1,73
[Mn2+] = 1,86∙10-2 моль/л
№376
По закону Фарадея:
m = I • M • t / (z • F)
t = m∙z∙F/I∙M = 0.1∙96500/5 = 1930 c.
На аноде выделится 0,1 моль эквивалентов вещества.
№418
Растворение хлорида серебра происходит за счет образования комплесных соединений:
AgCl+2Na2S2O3 = Na3(Ag(S2O3)2)+NaCl
AgCl + 2S2O32- = [Ag(S2O3)2]3- + Cl-
AgCl+2NH3 = (Ag(NH3)2)Cl
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
№389
В химически чистом железе практически нет примесей, с которыми могли бы возникать гальванические элементы, поэтому химически чистое железо меньше подвержено коррозии, чем техническое.
Катодный процесс: Fe – 2e = Fe2+
Анодный процесс: а) во влажном воздухе: 2H2O + 2e = H2 + 2OH-
Б) в сильнокислой среде: 2H+ + 2e = H2
№421
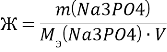
![]()
Имя файла: him4.docx
Размер файла: 28.16 Kb
Если закачивание файла не начнется через 10 сек, кликните по этой ссылке
