Примеры решенных задач по химии - 2
№ 28
Методы окислительно-восстановительного титрования: сущность, общая характеристика и классификация методов. Требования к реакциям. Кривые титрования: принцип построения и общий вид. Факторы, влияющие на величину скачка.
Методы окислительно-восстановительного титрования основаны на реакциях окисления-восстановления. Разработано очень много методов. Их классифицируют в соответствии с применяемым стандартным (рабочим, титрантом) раствором. Наиболее часто применяются следующие методы:
- Перманганатометрия - метод, который основан на окислительной способности рабочего раствора перманганата калия KМnO4. Титрование ведется без индикатора. Применяется для определения только восстановителей при прямом титровании.
- Иодометрия – метод, в котором рабочим титрованным раствором служит раствор свободного иода в КI. Метод позволяет определять как окислители, так и восстановители. Индикатором служит крахмал.
- Дихроматометрия основана на использовании в качестве рабочего раствора дихромата калия K2Cr2O7. Метод может применяться как для прямых так и косвенных определений восстановителей.
- Броматометрия основана на использовании в качестве титранта бромата калия KBrO3 при определении восстановителей.
- Иодатометрия применяет в качестве рабочего раствора раствор иодата калия KIO3 при определении восстановителей.
- Ванадатометрия дает возможность использовать окислительную способность ванадата аммоноя NH4VO3.
Кроме перечисленных методов в лабораторной практике используются и такие методы как цериметрия (Ce4+), титанометрия и другие.
Из большого числа окислительно-восстановительных реакций для химического анализа используют только те реакции, которые:
протекают до конца;
проходят быстро и стехиометрично;
образуют продукты определенного химического состава (формулы);
позволяют точно фиксировать точку эквивалентности;
не вступают в реакцию с побочными продуктами, присутствующими в исследуемом растворе.
Кривые титрования.
Процессы окислительно-восстановительного титрования можно представить графически в виде кривых титрования, изображающих изменение окислительно-восстановительного потенциала титруемого раствора по мере приливания к нему стандартного раствора окислителя или восстановителя (титранта). При титровании изменяется соотношение окисленной и восстановленной форм определяемого вещества и титранта, поэтому потенциалы редокс-пар рассчитывают по уравнению Нернста:
![]()
Расчет ведут по потенциалу той окислительно-восстановительной пары, компоненты которой находятся в избытке в данный момент титрования и концентрация которых легко может быть вычислена.
До точки эквивалентности потенциал рассчитывают по потенциалу пары определяемого вещества, а после точки эквивалентности – по системе титранта.
В точке эквивалентности потенциал системы определяется присутствием окислительно-восстановительных пар как определяемого вещества, так и титранта.
Поэтому потенциал в точке эквивалентности, Еэкв, можно рассчитать по уравнению, полученному суммированием уравнений потенциалов обеих пар при условии равенства в точке эквивалентности концентраций окисленных и восстановленных форм окислителя и восстановителя:
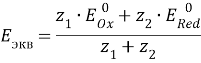
Расчет кривых титрования проводят для нахождения скачка титрования с целью выбора подходящего редокс-индикатора. Правильно выбранным индикатором является тот индикатор, у которого потенциал перехода окраски находится в пределах скачка титрования.
Скачок титрования в окислительно-восстановительном титровании – это резкое изменение потенциала окислительно-восстановительной системы в пределах допустимой погрешности измерения определяемого вещества.
Общий вид кривой титрования:
В начале титрования кривая изменяется плавно, а вблизи точки эквивалентности наблюдается резкое изменение потенциала. По резкому скачку кривой титрования устанавливают точку эквивалентности, которая не всегда лежит на середине скачка. Характер кривых титрования в окислительно-восстановительном титровании не зависит от разбавления раствора, если стехиометрические коэффициенты у окислителя и восстановителя одинаковы. Величина скачка титрования зависит от разности стандартных окислительно-восстановительных потенциалов редокс-пар, участвующих в реакции.
Область скачка на кривой окислительно-восстановительного титрования можно значительно расширить, регулируя кислотность среды, используя процессы комплексообразования или образования малорастворимых соединений, т. к. в этих случаях изменяется концентрация окисленной или восстановленной форм соответствующих редокс-пар.
№ 29
Способы фиксирования конечной точки титрования в окислительно-восстановительном титровании. Окислительно-восстановительные индикаторы, механизм действия, интервалы перехода, правила выбора индикатора.
Для обнаружения конечной точки титрования используют:
1) исчезновение или появление окраски титранта или титруемого вещества,
2) окислительно-восстановительные и специфические индикаторы,
3) инструментальные методы (потенциометрическое титрование и др.)
Окислительно-восстановительные индикаторы (редокс-индикаторы) представляют собой органические соединения, окисленная и восстановленная формы которых имеют различные окраски. Эти индикаторы имеют определенную окраску в пределах определенных значений окислительно-восстановительного потенциала. Интервал перехода редокс-индикаторов (pT) описывается уравнением
![]()
Окислительно-восстановительны индикаторы изменяют свою окраску в связи с достижением титруемым раствором определенного значения окислительно-восстановительного потенциала.
Чтобы окраска редокс-индикатора изменялась при титровании резко и индикаторная погрешность титрования была незначительной, интервал перехода индикатора должен находиться в пределах скачка потенциалов на кривой титрования.
В качестве окислительно-восстановительных индикаторов применяются дифениламин, N-фенилантраниловая кислота, ферроин, метиловый синий и др. Все эти индикаторы являются обратимыми, т. е. при избытке окислителя окрашиваются, а при избытке восстановителя обесцвечиваются и наоборот. При окислении или восстановлении молекула индикатора не разрушается, а лишь меняет строение. Кроме того существуют окислительно-восстановительные индикаторы, которые разрушаются необратимо при определенном потенциале (например, нейтральный красный, применяемый для броматометрического определения сурьмы).
№ 30
Методы комплексометрического титрования: сущность, общая характеристика и классификация методов. Требования к реакциям. Кривые титрования: принцип построения и общий вид. Факторы, влияющие на величину скачка.
Комплексометрическое титрование основано на реакциях образования комплексов. Среди реакций с участием неорганических лигандов применяются реакции образования галогенидов ртути (II), фторидов алюминия, циркония, тория и цианидов некоторых тяжелых металлов (никель, кобальт, цинк). Соответственно выделяют методы меркуриметрии, фторидометрии, цианидометрии. Кроме того выделяют комплексонометрию, или комплексонометрическое титрование – метод, основанный на использовании реакций образования комплексонатов – комплексных соединений катионов металлов с комплексонами.
Неорганические однодентатные лиганды (ОН-, F-, CN-, NH3 и др.) ограниченно применяются в комплексометрии. Это связано с тем, что однодентатные лиганды реагируют с ионами металла с координационными числами больше единицы ступенчато, с образованием спектра промежуточных соединений. Ступенчатые константы устойчивости промежуточных соединений близки друг к другу, вследствие чего скачки титрования на ТКТ, отвечающие отдельным ступеням реакции титрования, перекрывают друг друга. В результате получается ТКТ без скачков титрования, по которой невозможно подобрать индикатор, позволяющий регистрировать момент окончания образования какого-то конкретного комплексоната из спектра образующихся.
Этого недостатка лишены полидентатные лиганды с дентатностью больше пяти. Они с ионами металла реагируют в отношении 1: 1, вследствие этого соответствующая ТКТ имеет скачок титрования и по ней можно подобрать индикатор для регистрации ТЭ в реальном титровании.
Основным условием комплексометрического титрования является требование, предъявляемое к реакции, которая должна протекать таким образом, чтобы в точке эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости таких комплексов должна быть очень малой величиной.
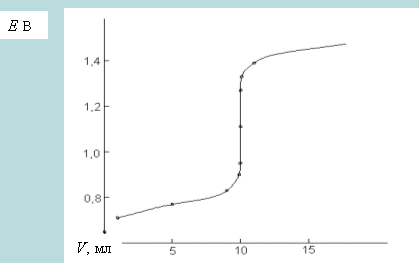
Кривые комплексометрического титрования обычно представляют собой зависимость рY = - lg[M] от объема титранта. До точки эквивалентности рассчитывается концентрация неоттитрованных ионов металла. В точке эквивалентности, которая соответствует скачку потенциала, фактически все ионы металла вошли в комплекс. После точки эквивалентности равновесную концентрацию ионов металла рассчитывают исходя из выражения для условной константы устойчивости.
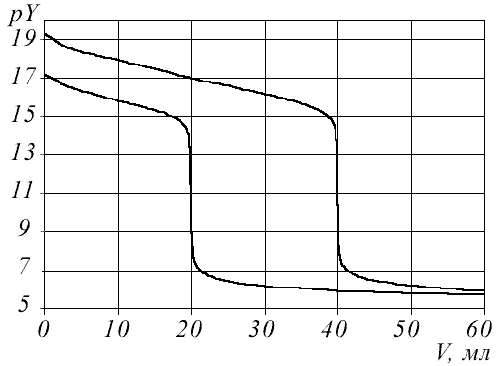
Скачок на кривой титрования зависит от:
константы нестойкости комплекса ( чем более устойчив комплекс, тем больше скачок титрования),
концентрации реагентов (чем больше концентрация, тем больше скачок),
рН титруемого раствора.
№33. Комплексонометрия: сущность и основные реакции метода. Стандартные и вспомогательные растворы, принцип построения и общий вид кривых титрования. Факторы, влияющие на величину скачка, возможности метода и его достоинства.
Комплексометрическое титрование (комплексометрия или комплексонометрия) основанно на применении реакций образования прочных комплексных соединений катионов с органическими реактивами, называемыми комплексонами.
Комплексоны являются производными аминополикарбоновых кислот. Простейшим комплексоном, известным под названием комплексон I, служит трехосновная нитрилотриуксусная кислота (сокращенно H3Y). Наибольшее значение приобрела этилендиаминтетрауксусная кислота (ЭДТУ), комплексон II, четырехосновная кислота (сокращенно H4Y). На практике обычно применяют динатриевую соль этилендиаминтетрауксусной кислоты, которую называют комплексоном III, ЭДТА, или трилон Б (сокращенно Na2H2Y). ЭДТА образует со многими катионами металлов устойчивые малодиссоциированные растворимые в воде внутрикомплексные соли. В комплексах часть связей носит ионный характер, часть – донорно-акцепторный. Трилон Б с ионами металлов любого заряда образует четырех- пяти- или шестикоординационный комплекс с пятичленными циклами. Атом металла находится в окружении атомов кислорода и атомов азота, находящихся в цис-положении.
Метод, в котором используют трилон Б, называют трилонометрией. Трилонометрический метод анализа основан на мгновенном образовании малодиссоциированных комплексных соединений различных катионов с трилоном Б. В водном растворе трилон Б диссоциирует и имеет кислую реакцию.
Nа2Н2Y = 2 Nа+ + Н2Y 2-
В реакциях комплексообразования реакции между трилоном Б и ионами металлов протекают стехиометрически в соотношении 1 : 1. Следовательно, молярная масса эквивалента ЭДТА и определяемого иона металла равны их молярным массам. При титровании ЭДТА солей металлов-комплексо образователей протекают следующие реакции:
М2+ + Н2Y 2- → МY2- + 2 Н+
М3+ + Н2Y 2- → МY- + 2 Н+
М4+ + Н2Y 2- → МY + 2 Н+
Образующиеся комплексные соединения различаются лишь по заряду. Ионы водорода понижают рН раствора, в результате повышения кислотности среды требуемого комплексного соединения может не получиться. Поэтому титрование проводят в буферном растворе, поддерживающем определенное значение рН.
Для титриметрического определения необходимо знать точную концентрацию вещества. Стандартным называется раствор, для которого известна точная концентрация растворенного вещества.
Кривые комплексонометрического титрования имеют следующий вид, содержат скачок титрования, по которому определяется точка эквивалентности. Принцип построения кривых комплексонометрического титрования такой же, как для комплексометрического титрования. До точки эквивалентности рассчитывается концентрация неоттитрованных ионов металла. В точке эквивалентности, которая соответствует скачку потенциала, фактически все ионы металла вошли в комплекс. После точки эквивалентности равновесную концентрацию ионов металла рассчитывают исходя из выражения для условной константы устойчивости.
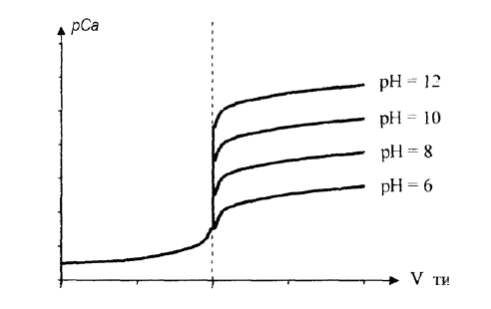
Скачок на кривой титрования зависит от:
константы нестойкости комплекса ( чем более устойчив комплекс, тем больше скачок титрования),
концентрации реагентов (чем больше концентрация, тем больше скачок),
рН титруемого раствора.
Комплексонометрическое титрование применяют для определения препаратов кальция, цинка, магния. Широко используют комплексонометрию при анализе воды для определения ее жесткости, которая вызвана присутствием солей кальция и магния. При этом можно определить как общую жесткость, используя индикатор эриохром черный Т или кислотный хромовый темно-синий, так и жесткость, обусловленную присутствием кальция, применив мурексид в качестве индикатора.
Комплексонометрическое титрование позволяет с высокой точностью проводить анализ различных сплавов и минералов. При этом возможно определение многих элементов при совместном присутствии, если использовать пригодные для этой цели металлохромные индикаторы и регулировать рН среды.
Метод комплексонометрического титрования точен, выполняется быстро и просто и имеет высокую избирательность, что обеспечило широкое применение метода в практике химического анализа.
№ 34. Способы фиксирования конечной точки титрования в комплексометрии, металлохромные индикаторы. Механизмы действия, интервалы перехода, правила выбора.
Конечную точку титрования устанавливают визуально по изменению окраски комплексонометрических индикаторов (металлоиндикаторов), а также потенциометрически, фотометрически, амперометрически или другими методами.
Металлоиндикаторы – это органические реагенты, обратимо изменяющие окраску под влиянием Меn+ -ионов. Индикаторы комплексонометрии также образуют с ионами внутрикомплексные соли, которые по условиям титрования должны быть менее устойчивы по сравнению с комплексонатами ионов данного металла; причём цвет комплексонов должен отличаться от цвета свободного индикатора.
Механизм действия металлоиндикаторов заключается в следующем.
М2+ + 2 НInd ↔ МInd2 + 2 Н+
Цвет 1 Цвет 2
Образовавшиеся комплексные соединения менее устойчивы, чем внутрикомплексные соли, которые образуются при титровании раствора катиона комплексонами.
МInd2 + Н2Y2- ↔ МY2- + 2 НInd
Цвет 2 Цвет 1
В точке эквивалентности комплексное соединение индикатора и металла разрушается, индикатор выделяется в свободном виде, а определяемый катион образует комплексное соединение с комплексоном. Окраска комплексного соединения индикатора и катиона отличается от окраски свободного индикатора, поэтому в точке эквивалентности происходит изменение окраски титруемого раствора.
Процесс образования комплекса между металлом и индикатором характеризуется константой устойчивости:
М + Ind ↔ МInd
![]()
Заметное изменение цвета раствора происходит при равенстве концентра-
ций [МInd] = [Ind], тогда:
![]()
![]()
Интервал перехода индикатора устанавливается при изменении соотношения [МInd] / [Ind] от 1/10 до 10/1 и будет равен:
рМ = lgβ ± 1
В качестве индикаторов в комплексонометрии применяют красители: мурексид, кислотный хром тёмно-синий, кислотный хромоген чёрный специальный (эрихром чёрный Т) и др. Последние два в щелочной среде имеют синюю окраску. Ионы кальция, магния и ряда других металлов образуют с индикаторами внутрикомплексные соединения (MeInd), окрашенные в вишнёво-красный цвет.
К металлоиндикаторам предъявляется ряд требований:
1) металлоиндикаторы должны в выбранной области рН образовывать с ионами металлов устойчивые комплексы MInd.
2) Комплекс иона металла с индикатором должен быть кинетически лабильным и быстро разрушаться под действием титранта.
3) Изменение окраски в конечной точке титрования должно быть контрасным.
№35. Методы осадительного титрования: сущность, общая характеристика и классификация, кривые титрования, принцип построения, общий вид. Способы фиксирования конечной точки титрования, анализ возможного достоинства и недостатка метода.
Методы осадительного титрования основаны на взаимодействии определяемого вещества с титрованным раствором осадителя, в результате которого выпадает осадок.
В методе осадительного титрования применяются титранты, образующие осадки с определяемыми веществами. При этом используют реакции, дающие осадки с произведением растворимости меньше 10-10, образовавшиеся осадки не выделяют и не взвешивают .
Наиболее широкое применение получили следующие методы осадительного титрования:
1. Аргентометрическое титрование, титрант – раствор АgNО3.
В основе метода лежит реакция образования трудно растворимого галогенида серебра.
Для определения анионов применяют нитрат серебра, для определения катионов серебра – хлорид натрия. Аргентометрическим методом титрования
пользуются главным образом для количественного определения галогенид-
ионов и ионов серебра.
2. Тиоцианометрическое титрование (роданометрическое), титрант –
раствор NН4CNS.
Роданометрическим методом титрования пользуются для определения галогенид-ионов и ионов серебра. Для определения катионов Аg+ в качестве
стандартного раствора используют роданид (тиоцианат) аммония, для определения галогенидов и других анионов – нитрат серебра и роданид аммония.
В качестве индикатора применяют насыщенный раствор железоаммонийных
квасцов.
3. Меркурометрическое титрование, титрант – раствор Нg2(NО3)2.
Этот метод основан на реакции осаждения раствором Нg2(NО3)2 различных анионов.
4. Сульфатометрическое титрование, титрант – раствор ВаСl2 или раствор Н2SО4.
Этот метод применяют для анализа солей бария, титруя их раствором Н2SО4 или для определения сульфатов титрованием раствором соли бария.
Точку эквивалентности в методах осадительного титрования определяют химическим путем (индикаторами на избыток титранта или исчезновение определяемого вещества), а также инструментальными методами.
В методе осаждения применяют следующие типы индикаторов: осади-
тельные, металлохромные (комплексообразующие) и адсорбционные.
Процесс титрования может быть охарактеризован кривой титрования, построенной в координатах: рМ или рГ – V, где рМ или рГ – взятый с обратным знаком логарифм концентрации ионов металла Мn+ или галогена Г-; V – объем титранта. Скачок титрования на кривой титрования зависит от растворимости осаждаемого соединения. Чем меньше растворимость осаждаемого
соединения, тем больше скачок титрования.
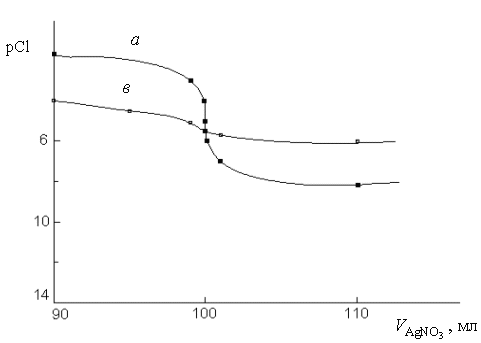
Осадительное титрование имеет ряд ограничений в использовании.
Использование этого метода для количественного определения анализируемого вещества возможно только в том случае, если выделяющиеся осадки практически нерастворимы, если реакция образования осадка протекает быстро, и если результаты титрования, не искажаются побочными реакциями соосаждения. Реакции осаждения при использовании в титриметрическом методе анализе обладают рядом недостатков:
- процесс осаждения обратим;
- небольшая скорость многих реакций осаждения;
- при образовании осадка определяемого вещества происходят процессы
соосаждения, адсорбции, образования коллоидов.
Однако существуют индикаторы, позволяющие фиксировать точку эквивалентности.
